中国国家癌症中心公布的数据,中国结直肠癌发病率在升高。其中发病率:男性第五,女性第四。每年约37.6万人诊断为结直肠癌,平均每天约1000人被确诊!其中发病率主要集中在 60~74 岁的年龄范围,占总体发病人数的 41.23%,而 45 岁以上发病的患者占所有结直肠癌新发病例的 93.28%。三分之一的患者初诊时已经是晚期。
以横结肠的脾曲为界,结肠癌分为左半结肠和右半结肠。左半结肠包括远端1/3的横结肠、降结肠、乙状结肠和直肠,右半结肠包括盲肠、升结肠和近端2/3的横结肠。
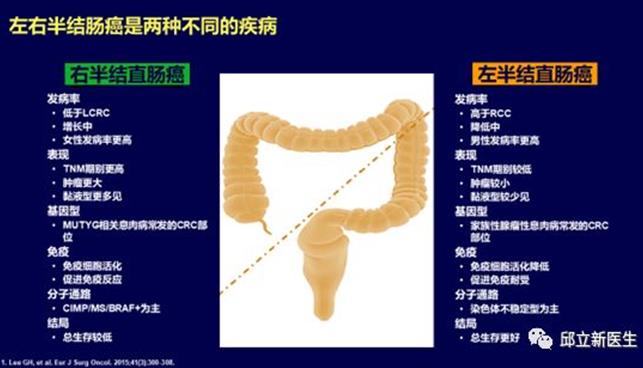
左半结肠和右半结肠具有不同的分子生物学特点和预后

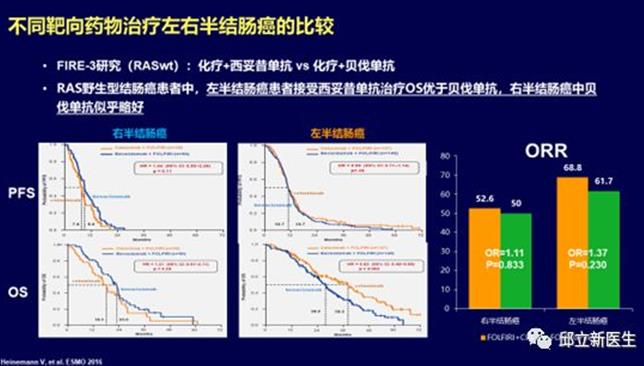
近期有较多回顾性研究数据表明原发瘤位于右侧(回盲部到脾曲)的转移性结肠癌预后明显差于左侧者(自脾曲至直肠)。对于 RAS 基因野生型的患者,抗 EGFR 单抗(西妥昔单抗)的疗效与肿瘤部位存在明显的相关性,暂未观察到抗VEGF单抗(贝伐珠单抗)的疗效与部位存在 明显关联。比较化疗联合贝伐珠单抗或西妥昔单抗的头对头随机对照研究的回顾性亚组分析数据显示:在左侧结直肠癌,西妥昔单抗在客观有效率和总生存上均优于贝伐珠单抗;而在右侧结肠 癌,西妥昔单抗虽然在客观有效率上可能存在一定优势,但在总生存上不如贝伐珠单抗。
晚期肠癌不是不治之症,很多患者经过积极的内科治疗后获得了手术的机会,获得了长期生存。
对于潜在可切除的患者,应选用 5-FU/LV(或卡培他滨)联合奥沙利铂或伊立替康的方案加分子靶向治疗,或高选择性患者可谨慎使用强力的 FOLFOXIRI± 贝伐珠单抗方案。转化治疗应密切评估转移灶可切除性,建议每 6~8 周行一次影像学评估,如转移灶转变成可切 除时,即予以手术治疗。
维持治疗:潜在可切除组如果接受转化治疗超过半年后转移灶仍无法 R0 切除,不建议手术切除,建议化疗±靶向的维持治疗。维持治疗选择的药物毒性低同时使用方便的药物,如5-FU/LV 或卡培他滨单药 ± 贝伐珠单抗或暂停全身系统治疗。
国内晚期结直肠癌治疗(CSCO指南)
潜在可切除治疗
1) RAS和BRAF野生型,原发灶位于左侧结直肠癌 FOLFOX/FOLFIRI± 西妥昔单抗。原发灶位于右侧结直肠癌 FOLFOX/CapeOx/FOLFIRI± 贝伐珠单抗;FOLFOXIRI± 贝 伐珠 单 抗 。
2) RAS和BRAF 突变型 不分左右半结肠,FOLFOX/CapeOx/FOLFIRI± 贝伐珠单抗;FOLFOXIRI± 贝 伐 珠 单 抗
姑息患者的治疗
一线治疗:
RAS和BRAF野生型 原发灶位于左侧结直肠癌 FOLFOX/FOLFIRI± 西妥昔单抗。原发灶位于右侧结直肠癌 FOLFOX/CapeOx/FOLFIRI± 贝伐珠单抗;
RAS和BRAF 突变型 不分左右半结肠,FOLFOX/CapeOx/FOLFIRI± 贝伐珠单抗。
二线治疗:
一线接受 奥沙利铂治疗(RAS 和 BRAF 均 野生型)FOLFIRI± 靶向药 物 (西妥昔单抗 或 贝伐珠单抗 );
一线接受 伊立替康治疗(RAS 和 BRAF 均 野生型)FOLFOX± 靶向药 物 (西妥昔单抗 或 贝伐珠单抗),CapeOx± 贝伐珠单抗 ;
一线接受 奥沙利铂治疗(RAS 或 BRAF突 变型)FOLFIRI±贝伐珠单抗;
一线接受 伊立替康治疗(RAS 或 BRAF 突 变型)FOLFOX/CapeOx±贝伐珠单抗;
一线未接受 伊立替康或奥沙利铂治疗 FOLFOX/FOLFIRI±靶向药物(西妥昔单抗或贝伐珠单抗 )、CapeOx± 贝伐珠单抗;
三线治疗:
瑞戈非尼、呋喹替尼或者临床试验
结直肠癌一线国内相关临床试验
试验题目
西妥昔单抗联合Folfoxiri方案对比西妥昔单抗联合Folfox治疗RAS野生型初始不可切除结直肠癌肝转移患者的随机对照临床研究。
适应症
一线治疗RAS野生型不可切除结直肠癌肝转移
试验目的
一线使用西妥昔单抗联合Folfoxiri方案对比西妥昔单抗联合Folfox获益的研究
试验设计
试验分类: 安全性和耐受性
试验分期: III期
设计类型: 平行分组
随机化: 随机化
盲法: 双盲
试验范围: 国内试验
入组条件
1.组织病理学检查确诊的RAS野生型结直肠癌。
2.年龄≥18 周岁且≤75 周岁 。
3.ECOG PS 评分为 0 或 1 分 。
4.既往(新)辅助化疗/辅助放疗结束时间至疾病复发时间>6 个 月。
5.针对局部病灶(非靶病灶)进行姑息性治疗结束时间至随机入 组时间> 2 周。
6.根据 RECIST v1.1 版,至少有一个可测量病灶或者可评估病灶。
7.具有充分的器官和骨髓功能,定义如下:1) 血常规:绝对中 性粒细胞计数( ANC) ≥1.5×109/L;血小板计数( PLT) ≥100×109/L;血红蛋白含量( HGB) ≥9.0 g/dL。2) 肝功能:无肝转移患者要求血清总胆红素( TBIL)≤1.5×正常上限 ( ULN);丙氨酸氨基转移酶( ALT)和天门冬氨酸氨基转移酶 ( AST) ≤2.5×ULN。有肝转移患者要求:血清总胆红素( TBIL)≤1.5×正常上限( ULN);丙 氨酸氨基转移酶( ALT)和天门 冬氨酸氨基转移酶( AST) ≤5×ULN。3) 肾功能:肌酐清除 率( Ccr) ≥50 mL/min(用 Cockcroft/Gault 公式计算):女 性:Ccr= (140-岁数) x 体重(kg) x 0.85 72 x 血清肌酐(mg/dL) 男性:Ccr= (140-岁数) x 体重(kg) x 1.00 72 x 血清肌酐 (mg/dL) 4) 凝血功能充分,定义为国际标准化比值( INR)或凝 血酶原时间( PT)≤1.5 倍 ULN;若受试者正在接受抗凝治疗, 只要 PT 在抗凝药物拟定的范围 内即可。
8.预期生存时间≥12 周。
9.育龄期女性受试者或性伴侣为育龄期女性的男性受试者,需在 整个治疗 期及治疗期后 6 个月采取有效的避孕措施 11.签署书面知情同意书,而且能够遵守方案规定的访视及相关程 序 。
结直肠癌二线国内相关临床试验
试验题目
MRG003治疗实体肿瘤的开放性、剂量探索的 I期临床研究
适应症
二线治疗结直肠癌
试验目的
Ia 期剂量递增阶段研究的主要目的:确定 MRG003的最大耐受剂量(MTD)或 II 期推荐剂量(RP2D)
Ib 期剂量扩增阶段研究的主要目的:评估 MRG003在晚期结直肠癌患者的抗肿瘤活性
试验设计
试验分类: 安全性和有效性
试验分期: I期
设计类型: 单臂试验
随机化: 随机化
盲法: 开放
试验范围: 国内多中心试验
入组条件
1.男性或女性,年龄18-70 周岁。
2.病理组织学和/或细胞学确诊为结直肠癌,并且为转移性或不可切除的晚期病例,且标准治疗失败,或无标准治疗,或现阶段不适合标准治疗。
3.一旦确认MTD, 剂量扩展组(MTD组)扩展入组受试者需要至少有一处符合RECIST 1.1标准的可测量病灶。既往放疗过的病灶不可作为可测量病灶,除非其在放疗后出现明确的影像学进展。
4.东部肿瘤协作组(ECOG)体力状态评分为0或1分。
5.预期寿命≥12周。
6.开始使用研究药物之前,既往抗癌治疗的所有毒性(脱发、疲乏或周围神经病变除外)必须均已恢复到1级或基线水平(NCI CTCAE第5版)。
7.男性心脏QTcF间期为 ≤450毫秒,女性为 ≤470毫秒。
8.实验室检查必须符合以下标准。筛选前14天内,不能通过输血或造血刺激因子对指标进行纠正以满足入组条件:a.血红蛋白≥90 g/L; b.血小板计数≥100 x 10^9/L ; c.绝对中性粒细胞计数(ANC)≥1.5 x 10^9/L;d.总胆红素 ≤1.5× ULN; e.ALT和AST≤3.0× ULN;有肝脏肿瘤时≤5.0× ULN;f.根据Cockcroft-Gault等式测得肌酐清除率>50 mL/min。
9.近1年内无酗酒、吸毒或药物滥用史。
10.具有生育能力的女性患者应在非哺乳期且治疗开始前5天内妊娠试验结果呈阴性 (尿液妊娠试验结果呈阳性需要通过血清妊娠试验进行确认)。
11.具有生育能力的女性和男性受试者必须同意从参加研究开始与其伴侣一起使用有效的避孕手段(手术绝育或避孕套或隔膜避孕措施与杀精子凝胶或子宫内避孕器结合使用[ IUD]), 直到最后一次用药后的6个月。
12.自愿参加本研究, 充分理解有关风险,依从性好,并且签署知情同意书。
结直肠癌三线及后线国内相关临床试验
试验题目
AST-3424治疗恶性肿瘤患者的I/II期临床试验
适应症
三线及后线治疗晚期结直肠癌
试验目的
评估 AST-3424 治疗晚期结直肠癌中的安全性和耐受性。
试验设计
试验分类: 安全性和耐受性
试验分期: II期
设计类型: 单臂试验
随机化: 随机化
盲法: 开放
试验范围: 国内试验
入组条件
1.男性或女性,年龄18-70 周岁。
2.病理组织学和/或细胞学确诊为结直肠癌,并且为转移性或不可切除的晚期病例,且标准治疗失败,或无标准治疗,或现阶段不适合标准治疗。
3.一旦确认MTD, 剂量扩展组(MTD组)扩展入组受试者需要至少有一处符合RECIST 1.1标准的可测量病灶。既往放疗过的病灶不可作为可测量病灶,除非其在放疗后出现明确的影像学进展。
4.东部肿瘤协作组(ECOG)体力状态评分为0或1分。
5.预期寿命≥12周。
6.开始使用研究药物之前,既往抗癌治疗的所有毒性(脱发、疲乏或周围神经病变除外)必须均已恢复到1级或基线水平(NCI CTCAE第5版)。
7.男性心脏QTcF间期为 ≤450毫秒,女性为 ≤470毫秒。
8.实验室检查必须符合以下标准。筛选前14天内,不能通过输血或造血刺激因子对指标进行纠正以满足入组条件:a.血红蛋白≥90 g/L; b.血小板计数≥100 x 10^9/L ; c.绝对中性粒细胞计数(ANC)≥1.5 x 10^9/L;d.总胆红素 ≤1.5× ULN; e.ALT和AST≤3.0× ULN;有肝脏肿瘤时≤5.0× ULN;f.根据Cockcroft-Gault等式测得肌酐清除率>50 mL/min。
9.近1年内无酗酒、吸毒或药物滥用史。
10.具有生育能力的女性患者应在非哺乳期且治疗开始前5天内妊娠试验结果呈阴性 (尿液妊娠试验结果呈阳性需要通过血清妊娠试验进行确认)。
11.具有生育能力的女性和男性受试者必须同意从参加研究开始与其伴侣一起使用有效的避孕手段(手术绝育或避孕套或隔膜避孕措施与杀精子凝胶或子宫内避孕器结合使用[ IUD]), 直到最后一次用药后的6个月。
12.自愿参加本研究, 充分理解有关风险,依从性好,并且签署知情同意书。
转自邱立新医生微信公众号
