2019年12月9日,国家药品监督管理局正式批准阿斯利康PD-L1单抗Imfinzi(durvalumab, 度伐利尤单抗注射液,中文商品名:英飞凡,简称I药)用于治疗不可切除III期非小细胞肺癌(NSCLC)的患者。Imfinzi先前已于2018年2月16日获得美国食品和药物管理局对该适应症的批准。Imfinzi是一种直接靶向PD-L1的人源单克隆抗体,它通过阻断PD-L1与T细胞上的PD-1和CD80的相互作用,抵抗肿瘤的免疫逃避手段,并诱导免疫应答,帮助人体的免疫系统攻击癌细胞。
临床研究
Imfinzi的批准是基于代号为PACIFIC的临床试验。该研究是一项随机、双盲、安慰剂对照、多中心的Ⅲ期临床试验。该研究共招募了713名患者,这些患者在完成放化疗后并无疾病进展,并将患者按照2:1的比例接受随机分组。该试验主要终点是疾病无进展生存期和总生存期。结果显示,接受Imfinzi的患者的OS有显著改善,并具有统计学和临床意义,抵达了主要终点接受Imfinzi的患者的中位无进展生存期为16.8个月,而接受安慰剂的患者为5.6个月。Imfinzi组与安慰剂组的三年生存率分别为57%和43%。
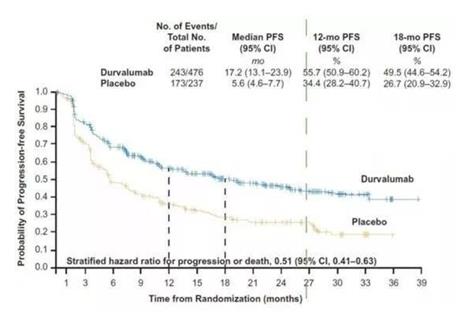
PACIFIC研究中患者无进展生存期数据对比
用法剂量
推荐剂量为每2周静脉输注10 mg / kg,直到疾病发生进展,不可接受的毒性或最多12个月。
副作用及不良反应
在III期不可切除的NSCLC患者中常见的副作用包括咳嗽,疲劳,肺部炎症(肺炎/放射性肺炎),上呼吸道感染,呼吸困难(呼吸困难)和皮疹。
严重风险包括免疫介导的副作用,人体的免疫系统会攻击健康的细胞或器官,例如肺(肺炎),肝(肝炎),结肠(结肠炎),产生激素的腺体(内分泌病变)和肾脏(肾炎)。
可能对发育中的胎儿造成伤害;应告知妇女胎儿的潜在危险,并采取有效的避孕措施。
其他严重副作用包括感染和输液相关反应。