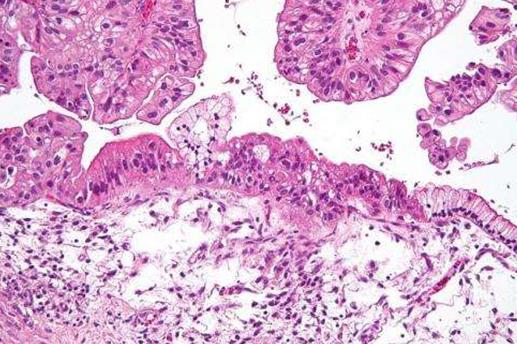
低恶性潜能(LMP)粘液性卵巢肿瘤的中间放大显微照片。H&E污渍。显微照片显示:简单粘液上皮(右)和伪分层的粘液上皮(左-LMP肿瘤的诊断)。在图像的顶部可以看到叶状结构的上皮。图片来源:Nephron / Wikipedia。CC BY-SA 3.0
导致大多数卵巢癌的流氓细胞引擎仍然令人沮丧地难以停用。一项将癌组织与正常输卵管样本进行比较的新研究为这种机制提供了重要的见识,并证实了其生存的生物学特征。
高度浆液性癌是最常见的卵巢癌类型,其生存率最低。为了更好地了解这种疾病及其进展,美国能源部太平洋西北国家实验室的研究人员及其合作伙伴对从全球83例患者身上采集的组织蛋白中的蛋白质组(数千种蛋白质)进行了检查。他们的结果发表在4月的《细胞报告医学》杂志上,可以帮助确定更具针对性的治疗方法。
寻找卵巢癌的开“关”
成功治疗任何癌症都需要阻止其异常细胞复制和扩散。就卵巢癌(女性癌症死亡的第五大原因)而言,科学家们正在寻找合适的“关闭”靶点。
PNNL科学家,该研究的通讯作者卡琳·罗德兰(Karin Rodland)说:“细胞是非常复杂的机械零件。有很多方法可以破坏机械,然后导致癌症。” “如果您不知道发生了什么问题,就无法修复它。”
称为蛋白质组学的相对较新的分析技术提供了线索。过去二十年来发展起来的蛋白质组学不仅研究细胞的遗传学,而且研究它们如何通过数千种蛋白质进行交流和发挥作用。早期的研究方法专注于如何通过核糖核酸或RNA表达遗传突变,而蛋白质组学分析则揭示了癌细胞之间发生的变化的更多细节。
现在,作为美国国家癌症研究所临床蛋白质组学肿瘤分析联合会的一部分,科学家们正在努力理解蛋白质的宇宙。作为这项工作的一部分,2016年对存档的肿瘤样品进行了具有里程碑意义的蛋白质组学分析,确定了与卵巢高级浆液性癌相关的特定细胞过程。
这项新研究证实了这些发现,并通过将癌变组织与正常输卵管样本进行比较,提供了更为清晰的图像,支持了这样的观念:卵巢癌并非像先前所认为的那样在卵巢表面开始,而是在输卵管末端开始。
该研究还提供了更可靠的数据,因为使用严格的手术方案收集了组织样本,从而消除了人体对手术的压力反应,这是一个潜在的复杂因素。
罗德兰说:“据我们所知,这是首次真正的深度比较输卵管组织和卵巢癌组织的蛋白质水平。” “能够在第二批种族和种族多样化的女性中复制2016年的发现,证明了最初观察的力量。”
PNNL科学家,该研究的通讯作者刘涛补充说:“这一精心采购的组织样本,以及对蛋白质和磷酸化蛋白质的全面,同时分析,使我们能够准确地概括细胞活动,例如应激反应和在癌症和相关正常组织中复制”。
卵巢癌背后的机械破裂
研究人员将两个过程特别联系到了高度浆液性癌,有时将其称为“染色体断裂病”。首先涉及由肿瘤细胞失控产生的应激反应。这种效应被称为增殖诱导的复制压力,在肿瘤基因组中造成不稳定。
第二个过程是同源修复缺陷,即无法修复受损细胞。这两个过程共同导致了卵巢癌的顽固,不受控制的生长方式。
罗德兰说:“ 不仅仅是肿瘤细胞被卡在生长的位置上。” “在卵巢癌中,也存在DNA修复不足的背景。因此,每当细胞复制时,就会引入突变和断裂的染色体。”
该研究得到了CPTAC和美国国立卫生研究院(National Institutes of Health)的支持,也证实了以前的发现,这些发现将某些蛋白质的丰富与更高的存活率联系在一起。
鉴定与导致卵巢癌的过程以及增加的生存机会相关的蛋白质,将打开针对特定增殖途径的可能的治疗策略,包括使用目前市场上的药物。
罗德兰说:“医生可以利用这些数据对治疗方案进行分层。” “我们还可以研究存活时间较短的女性,然后提出一种替代疗法,比标准疗法更适合这些女性。”