癌细胞因基因混乱而臭名昭著。肿瘤细胞可以包含大量的DNA突变,并且大多数具有错误的染色体数。单个染色体的缺失或多余副本会造成称为非整倍性的失衡,这会扭曲数百或数千个基因的活性。随着癌症的发展,非整倍性也随之发展。一些晚期肿瘤可以容纳已累积100多个染色体的细胞,而不是正常细胞中的46个染色体。
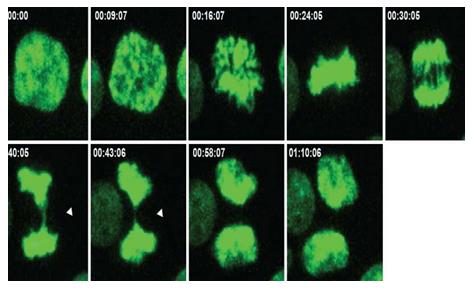
时间序列显示了细胞分裂的过程,箭头指向导致染色体数目失衡的位置。现在的研究表明,在癌细胞中染色体失衡可以促进或抑制转移。
高水平的非整倍性与侵袭性癌症和患者预后不良有关。但是,根据冷泉港实验室研究人员Jason Sheltzer及其同事的说法,并非所有非整倍体都能促进癌症的进展。在《发育细胞》杂志上,他们报道了一些非整倍性抑制了癌症的转移能力。
Sheltzer说,虽然非整倍体是癌症很常见的细胞,它一直没有明确这些异常是否有助于推动疾病。他的团队与凯撒斯劳滕大学的ZuzanaStorchová合作,开发了新的工具来研究癌细胞获得额外染色体后行为的变化。他们设计了一组人类细胞,每个细胞都有一个不同染色体的额外拷贝,但在其他方面却是相同的。
当博士后研究员阿南德·瓦苏德万(Anand Vasudevan)在实验室测试这些细胞时,结果令人惊讶。Sheltzer说:“由于高度侵袭性的癌症往往是非整倍体,因此我们预计所有或大多数非整倍体都会导致转移行为。但是实际上这是一个更复杂的关系。我们发现不同的染色体会产生各种不同的影响。 一些额外的染色体对转移没有影响,而另一些实际上抑制了转移。”
对患者数据的分析显示出类似的情况。虽然在癌症总体上具有非整倍性水平高的患者中,生存率最差,但研究小组确定了某些染色体,这些染色体的额外拷贝与增加的生存率相关。这些有益的非整倍性不及那些与不良生存有关的非整倍性。这可能是因为随着疾病的进展,最有可能持续的变化是有助于肿瘤蓬勃发展的变化。Sheltzer说,它们的存在表明非整倍性的临床影响可能与实验室实验提示的一样复杂。
Sheltzer的小组正在研究实验中增强转移的单一非整倍性,以了解该染色体的额外副本如何增强癌细胞的侵袭行为。他们还将使用新的非整倍体细胞系来筛选潜在的药物和基因改变,这些药物和基因改变可通过针对这些异常来消除癌细胞。