通过临床试验,已经证明该药物的安全性与其有效性。UT西南医学中心肾脏癌计划研究小组的发现,发表在2月15日的《临床癌症研究》上,揭示了这种癌症的弱点,将来可以通过其他靶向治疗进一步加以利用。
在美国,每年大约诊断出70,000例新病例的透明细胞肾细胞癌(ccRCC)。与其他癌症相比,诊断后的五年预期寿命很低,约为10-12%。与许多其他形式的癌症不同,ccRCC对化学疗法或传统放射疗法无反应。
研究主要作者James Brugarolas医学博士,内科学教授(血液学/肿瘤学)和UT Southwestern的肾脏癌计划主任在二十年前开始他的职业生涯时,只有一种药物被批准用于治疗这种癌症。现在,有超过12种已批准用于ccRCC的药物。但是,布鲁加罗拉斯说,每一种药物都只能对生存产生一定程度的影响,并且会带来许多副作用。
为了寻找更好的药物来对抗这种癌症,肾脏癌计划的研究人员专注于一种称为低氧诱导因子2α(HIF-2α)的蛋白质,该蛋白质在UTSW的研究人员于1990年代后期首次发现和描述。HIF-2α是一种被称为von Hippel-Lindau(VHL)的抑癌蛋白的靶标,该蛋白在大多数ccRCC情况下均失活。当HIF-2α与HIF-1β配对时,它能够调节100多个基因的表达,其中包括许多在癌症中起关键作用的基因,例如控制血管形成或维持干细胞样质量的基因。
尽管长期以来一直认为HIF-2α不可吸收,但UTSW研究人员在2009年发现了该蛋白质结构中的一个漏洞,该囊袋在与HIF-1β结合中起着关键作用。最终,UTSW的研究人员鉴定出了可束缚此囊袋的化合物,这是在西南医学区UTSW生物中心成立Peloton Therapeutics Inc.以及开发HIF-2α抑制剂药物PT2385的基础。在动物模型中进行了广泛的临床前测试后,UTSW及其同事的科学家进行了一项第一阶段的临床试验,结果表明该化合物安全,耐受性良好,并且可以有效地控制40%的患者的癌症。
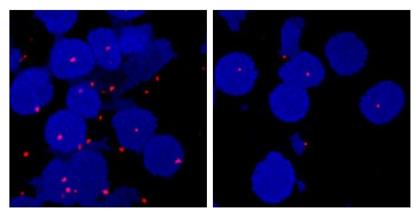
红点代表肾癌细胞中的HIF-2复合物,蓝色圆圈代表肾癌细胞,当HIF-2α和HIF-1β蛋白结合在一起时形成配对产生了一个分子开关,打开了通信通道并激活了负责血管生成的基因,帮助癌细胞生存。HIF-2阻断药物PT2385分解了复合物,根据右图所示,其中红点已基本消失。图片来源:UT西南医学中心
通过对参与第一阶段研究并愿意进行广泛测试的部分患者进行的深入研究,研究人员试图确定PT2385在ccRCC患者中阻断HIF-2α的程度,作用的特异性以及如何发挥作用。重要的HIF-2α是用于癌症。
研究者发现,患者开始使用该药物后两周内,其肿瘤中的血液循环量平均减少了约29%。UTSW放射学教授,磁共振成像主管,医学博士,医学博士,医学博士Ivan Pedrosa博士说,虽然接受测试的患者队列相对较小,但结果表明该药物正在使血液中的肿瘤饿死。与其他所有试图阻止血液流向肿瘤的其他药物不同,PT2385的作用对该癌症具有特异性。
在肿瘤内,对活检组织的测试表明PT2385有效溶解了HIF-2α/HIF-1β,从而阻止了复合物激活促癌基因。该作用具有高度特异性,其他相关复合物(例如HIF-1α/HIF-1β)不受影响-显示其对HIF-2α的极端特异性。