图1:研究示意图
KAIST的研究人员已经确定了将先前针对一线化疗研究的癌症耐药性的“多米诺效应”延伸至二线靶向治疗中来进行研究。他们的研究发表在2月7日的《科学进展》杂志上,提出了一种新的策略,可以改善耐药患者的二线治疗。
临床上通常通过化学疗法和靶向疗法来控制对癌症药物的耐药性。与通过抑制快速增殖的细胞而起作用的化学疗法不同,靶向疗法可阻止单一致癌途径阻止肿瘤的生长。在许多情况下,靶向治疗可作为维持治疗或在一线化疗后用于二线治疗。
化学和生物分子工程学系以及日本科学技术研究院健康科学与技术学院(KIHST)的Yoosik Kim教授领导的一组研究人员发现,化学疗法和靶向疗法之间出现了意外的耐药性。研究小组进一步确定了一套促进这种顺序治疗耐药性的整合机制。
论文的第一作者马克·鲍里斯·D·阿尔登萨说:“已经有多个临床报道反映出,在用尽所有标准治疗方法的患者中,靶向疗法往往是最不成功的。” 他继续说:“这些说法激发了我们的假设,即对某些化学疗法的反应失败可能会加速对其他药物,特别是具有特定靶点的药物的耐药性的演变。”
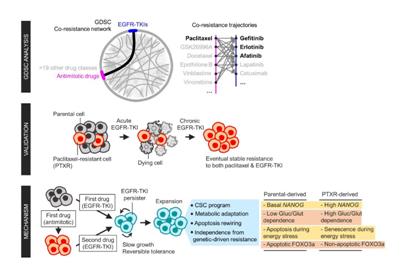
Aldonza和他的同事从开源数据库癌症中的药物敏感性基因组学(GDSC)中提取了大量的药物抗性信息,其中包含来自各种人类癌细胞系的数千个药物反应数据条目。他们的大数据分析表明,对化学疗法具有抗性的癌细胞系被归类为抗有丝分裂药物(AMDs),这是一种抑制过度分裂细胞的毒素,对一种称为表皮生长因子受体酪氨酸激酶抑制剂(EGFR- TKIs)。
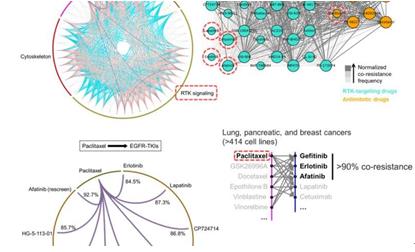
图2.大数据分析揭示了抗癌药物类别之间的抗药性
在所有分析的癌症类型中,超过84%的对AMD耐药的患者(代表性的是“紫杉醇”)也对至少9种EGFR-TKI耐药。在肺癌,胰腺癌和乳腺癌中,紫杉醇常被作为首选符合标准的在线护理方案中,有超过92%的患者表现出对EGFR-TKIs的耐药性。金教授说:“令人惊讶的是,我们发现这种附带耐药性可以在两种化学上不同的药物之间发生。”
为了弄清对紫杉醇的耐药性如何导致了对EGFR-TKI的耐药性,研究小组通过生成和分析了慢速倍增的紫杉醇耐药癌症模型(称为“持久性”)的子集,验证了他们在数据库中发现的共耐药性特征。
结果表明,耐紫杉醇的癌症首先变得更像干细胞,它们会重塑自身的压力反应,从而发展出自我更新的能力,以适应更多的压力条件。更令人惊讶的是,当研究人员表征细胞的代谢状态时,源自耐紫杉醇的癌细胞的EGFR-TKI持久性分子显示出对糖酵解和谷氨酰胺分解等能量产生过程的高度依赖性。
“我们发现,在没有像葡萄糖这样的能量刺激的情况下,这些细胞会转变为更加衰老,这是阻止细胞分裂的细胞的特征。但是,这种衰老是由干细胞因子控制的,这为癌症的重新成长创造了有利条件。”
金教授解释说:“在进行这项研究之前,我们没有想到能够证明影响代谢和细胞死亡的癌症干细胞表型会与化疗、靶向治疗的耐药性关系密切。”