2011年因发现树突状细胞,诺贝尔医学和生理学奖颁发给了加拿大科学家 斯坦曼。树突状细胞在恶性肿瘤免疫循环中发挥着不可替代的抗原递呈作用,后被医学界运用于癌症的免疫疗法。2018年诺贝尔医学和生理学奖颁发给了日本京都大学的特别教授本庶佑和美国德克萨斯大学的詹姆斯艾里森教授。两人发现了一种抑制人类免疫系统对抗癌细胞的机制,并发布了一种新的癌症免疫疗法(免疫检查点抑制剂,简称ICI),通过释放人类免疫系统的正常功能来提高疗效。到目前为止,人们熟知手术,化学疗法和放射疗法是癌症的三大标准疗法,而“癌症免疫疗法”使用患者自身的免疫系统来治疗癌症,提高了癌症患者更长期生存的可能。在癌症的免疫循环中(图2),各种细胞疗法和ICI各自发挥作用,使人类癌症通过自愈途径达到治愈成为可能。本文以Q&A(Q:Question&A:Answer)的形式介绍癌症免疫疗法,以便非医学读者能对免疫疗法有所了解。
Q01:什么是癌症的免疫机制?
Answer
人类的免疫是一种区分“自体”与“异物”,并清除“异物”的系统。异物包括从体外侵入的病原体(如病毒、细菌),以及体内自然生成的异物(如异常细胞、癌细胞)。免疫系统正常工作时确保人类处于健康状态。免疫系统按功能可分为自然免疫和获得性免疫。
免疫由多种免疫细胞、细胞因子和循环系统构成,免疫细胞在身体中巡逻,每当发现异物,它们立即开始工作以清除异物。这种机制称为“自然免疫”,如:NK细胞、巨噬细胞和树突状细胞等APC。
免疫系统中还有另一种“获得性免疫”,也称特异性免疫。把获得性免疫看作一种免疫机制更容易理解,这种机制为免疫提供强大的攻击力,获得性免疫主要由T细胞和B细胞等淋巴细胞负责。自然免疫提供异物的特征信息(也称标记物,癌抗原)后,诱发特异性免疫,效应细胞开始增殖和激活,然后攻击外来之敌。
树突状细胞在将癌细胞信息传递至获得性免疫中起重要作用。树突状细胞通过传递被称为“抗原”的蛋白质(异物特有的蛋白,与正常细胞的蛋白不同)信息,来引导T细胞作出反应。接收到抗原信息的T细胞迅速转化为杀伤性T细胞,以攻击并清除癌细胞。当相同癌细胞再次出现时,记忆性T细胞、B细胞等立即反应,攻击和清除癌细胞。
Q02:癌症与免疫有何种关系?
Answer
在我们体内发育的癌细胞是因基因异常而产生的异常细胞。有个“癌症免疫监视”的概念,即免疫可以清除作为异物的癌细胞并保护生物体。通常,免疫系统应该能够通过监视,清除癌细胞来防止其增殖,形成癌组织。而实际上,癌细胞具有无限期分裂增殖的天性,控制不住即可致命。这不能仅用“免疫监视理论”来解释。
因此,“癌症免疫学编辑理论”的概念被广泛接受。癌症的免疫编辑指癌细胞在生存演化过程中设计了从免疫监视中逃逸的机制,这一概念进一步发展了“免疫监视理论”,我们将免疫监视和免疫编辑融合,理解了“恶性肿瘤的免疫循环”(图1),相应的免疫疗法也应运而生(图2),并将癌症与免疫的关系分成了三个阶段。“清除期”、“平衡期“、“逃逸期”。
图1.免疫监视下的循环
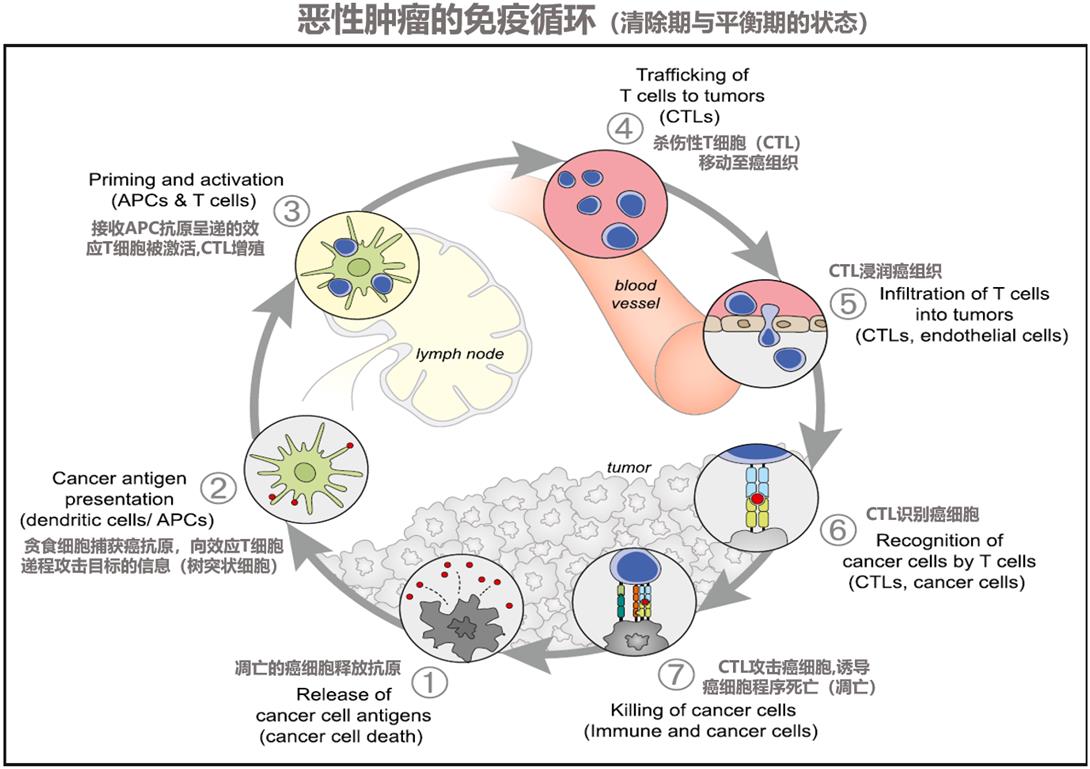
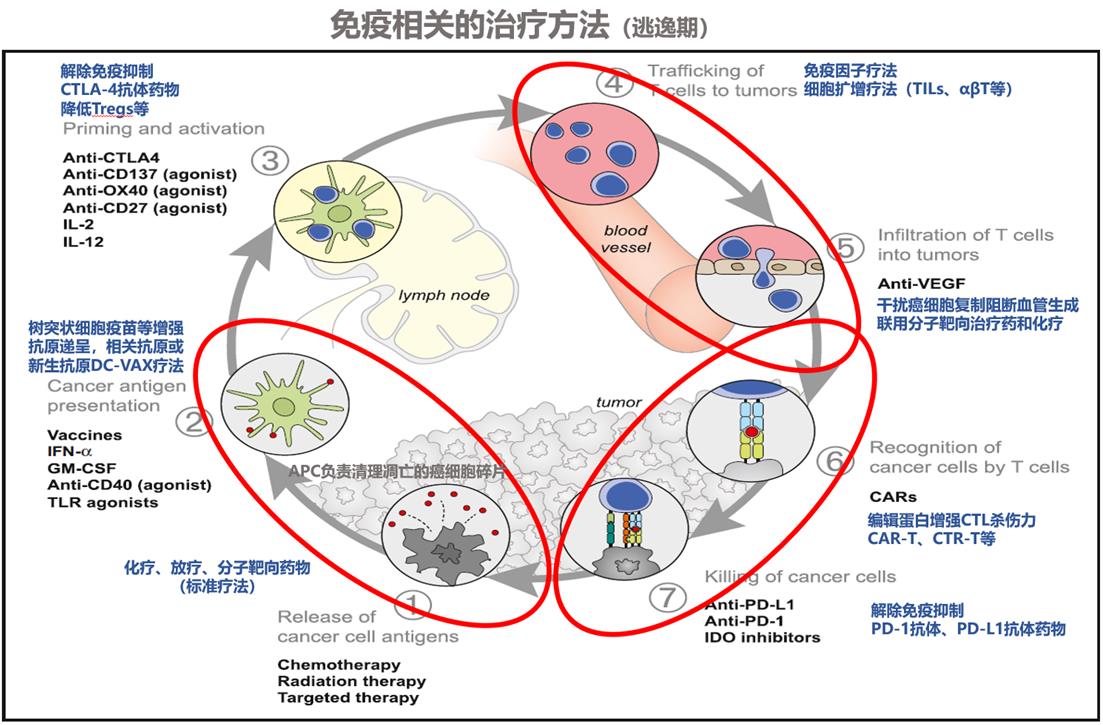
图2.癌症的免疫循环和可用的免疫疗法
首先是清除阶段。当某些细胞因基因突变发生变异,即癌细胞在机体内产生时,免疫会立刻将其作为异物识别,然后对癌细胞进行攻击和清除。通常认为我们每天机体内会产生3,000~5,000个癌细胞(来自于正常的突变或复制错误),在清除阶段,免疫清除确保我们不发生癌症。
但是,癌细胞为了自身的生存也是拼尽全力的。癌细胞试图弱化其作为异物的特性,以减少被免疫细胞识别和攻击的概率。例如,当经过抗原递呈的T细胞攻击癌细胞时,要通过癌细胞上的MHC(相容性复合体:major histocompatibility complex)分子来识别癌细胞。聪明的癌细胞会隐藏自己的部分MHC分子或特异性蛋白(抗原),以躲避T细胞的攻击。这个时期癌组织不增大,与免疫处于相持状态,这个阶段称为平衡期。
癌细胞为了增强自己的势力,将要采取的下一个策略是抑制免疫。正常状态下,为了抑制过度的免疫反应,维持我们机体的常态,机体中本身存在免疫抑制类细胞,如调节性T细胞(Tregs)和免疫检查点分子(PD-1/PD-L1,2等)。癌细胞利用这些天然的资源构架自己的免疫抑制机制,以达到自身的生存和增殖目的。这个阶段是免疫逃逸阶段,即逃逸期。
在临床上被诊断为癌症时,癌细胞已经处于逃逸期。也就是说癌细胞已经经历了清除期和平衡期,进入了逃逸期。作为新生物的癌细胞对免疫做了手脚,制造免疫抑制,干扰了正常的免疫状态,可以自由增殖了。
Q03什么是免疫检查点?
Answer
2018年诺贝尔医学和生理学奖得主,日本京都大学的本庶佑教授和美国德克萨斯大学特聘教授艾里森的研究成果,颠覆了过去单方面激活免疫的治疗方法(免疫因子、细胞疗法等),解除癌细胞抑制免疫的新方法进一步完善了癌症免疫疗法。
过去的癌症免疫疗法常使用干扰素α(IFN-α)和白介素等免疫因子,单纯增殖免疫细胞,癌症疫苗等。我们把癌症病人的免疫比作一部正在公路上行驶的汽车,过去的免疫疗法单纯加大油门,但汽车有故障自带刹车,到不到速度最大化,而新的免疫疗法能解除刹车。加油门和解除制动都能使汽车跑的更快。
本庶佑和艾里森的新发现,使我们找到了解除免疫刹车的抗癌策略。免疫检查点分子是控制免疫应答的分子(刹车),为了不让免疫细胞攻击自己,通常免疫检查点分子抑制着T细胞,不允许T细胞活性过强(过强会带来自体免疫疾病)。
人们创造了一类新药物来解除免疫刹车。该方法旨在解决逃逸期的免疫逃逸,并在临床上显示了出人意料的疗效。
Q04.都有什么免疫检查点
Answer
两位教授的研究都是独立进行的。
本庶佑教授的研究小组旨在解析由T细胞诱发的细胞程序性死亡(凋亡)。获得性免疫的T细胞在完成清除异物的工作后,仅将抗原信息储存在记忆性T细胞中,受到T细胞攻击的癌细胞会自行凋亡。为了寻找这种凋亡的路径,研究小组一直在研究与这种凋亡有关的基因。在1992年研究小组在活性T细胞上发现了PD-1(程序性凋亡蛋白1)蛋白。PD-1中的PD意思为“细胞程序性凋亡”。
同时,艾里森教授的小组深入研究了法国小组于1987年发现的CTLA-4(细胞杀伤性淋巴细胞抗原4)蛋白,该蛋白与激活识别癌细胞的DC(树突状细胞)及T细胞有关。1995年的研究发现,它具有阻止抗原信息传导和阻止T细胞攻击癌细胞的功能。当时猜测控制CTLA-4可以解除T细胞上的刹车,释放T细胞的攻击力。在1996年,研究人员对移植有癌细胞株的小鼠投放了CTLA-4抗体,证实了小鼠癌组织的退缩和消失。2011年美国FDA批准了世界上第一个免疫检查点抑制剂(ICI)伊匹木单抗(商品名称:Yervoy)。
本庶佑小组的研究明确了PD-1与癌细胞表面上被称为PD-L1/2的刺激分子结合后,抑制了T细胞的功能,并且开始研究阻断PD-1与PD-L1/2的方法,于2014年在日本首次批准了PD-1抗体药物nivolumab(商品名称:Opdivo)。后来,众所周知的PD-1抗体、PD-L1抗体药物陆续登场。
此外,日本德岛县的一个酵素研究所又发现了第3个免疫检查点分子LAG-3。LAG-3已经被完全解析,它利用单分子可以多样性地抑制T细胞活性,LAG-3的发现不仅有望用于治疗癌症,还有可能治疗自体免疫疾病。目前科学研究刚刚起步,到制造出可以为患者治疗的药物还有相当长的路要走。
Q05.免疫检查点分子PD-1和CTLA-4有何区别
Answer
PD-1和CTLA-4均充当着通过免疫检查点分子抑制免疫活性的角色,他们抑制免疫清除癌细胞,但作用机制不同。
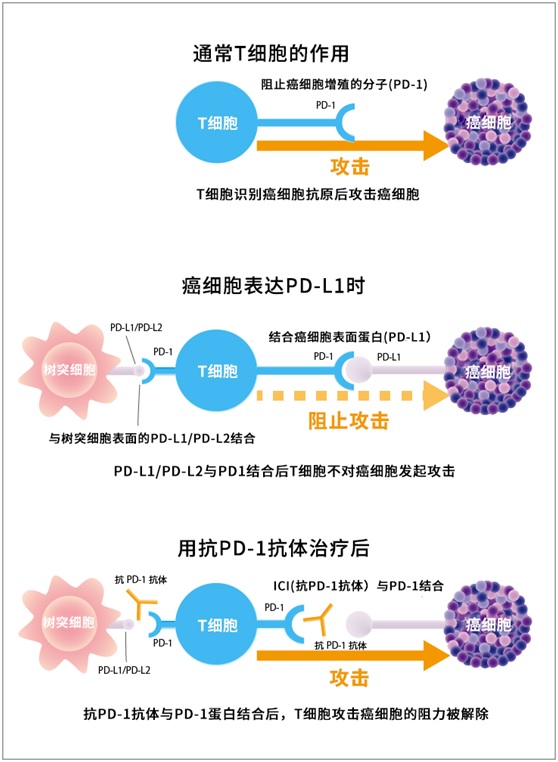
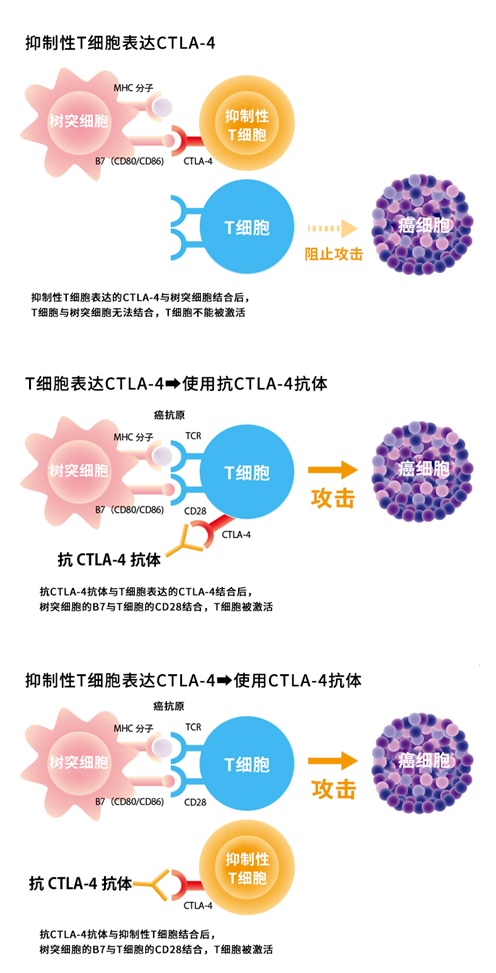
通过与T细胞膜上表达的PD-1结合而传递信号的分子PD-L1和PD-L2常在癌细胞表面表达。阻断两者的联系(信号传导)后,可以让T细胞发挥抗癌作用。此外,树突状细胞上也有PD-L1和PD-L2表达,同样阻断信号,发挥DC的抗原呈递能力,能进一步激活T细胞(图3)。
图3抗PD-1抗体和抗PD-L1抗体药物如何工作
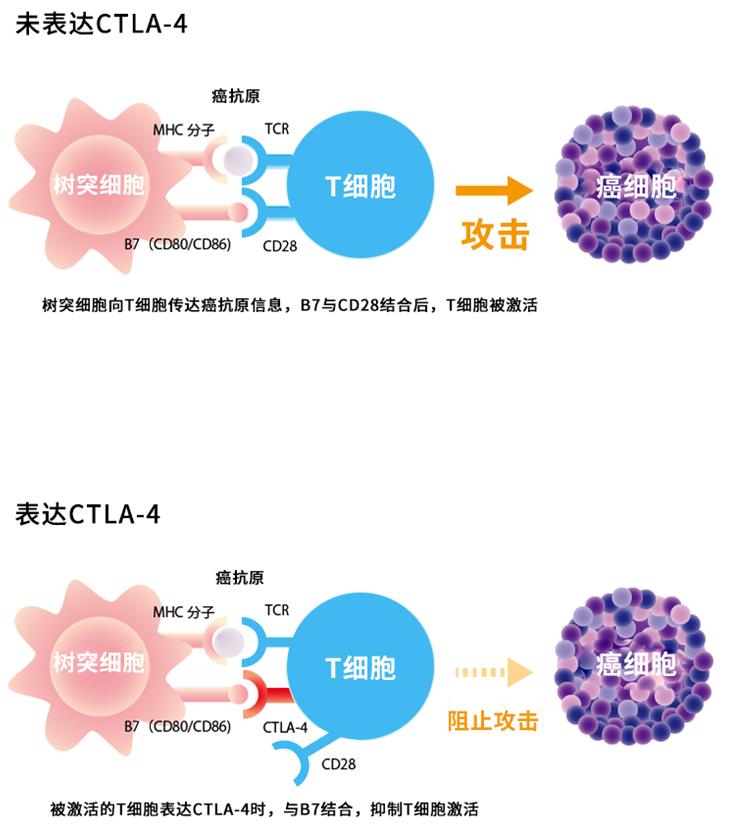
CTLA-4与PD-1不同,CTLA-4存在于效应性T细胞表面,CTLA-4通过与关联细胞表面的B7结合来抑制效应性T细胞的活性,等于为T细胞踩了刹车。B7存在于抗原递呈细胞APC上,如树突状细胞。此外,由于CTLA-4经常在具有免疫抑制功能的调节性T细胞上表达,因此癌细胞也可以利用调节性T细胞(Treg)来抑制T细胞的功能。
因此,通过阻止CTLA-4与B7(CD80 / CD86)结合,来释放并激活T细胞的制动,可以达到攻击癌细胞的目的(图4)。
图2抗CTLA-4抗体药物如何工作
现在,已获批的ICI包括抗PD-1抗体,抗PD-L1抗体和抗CTLA-4抗体3类药物,他们可以单独使用、互相联用,也可以和部分化疗药物及分子靶向药物、免疫细胞疗法联合使用,在保证患者安全的情况下,力图为癌症患者找到更多的解决方案,期待更佳的疗效。
世界各国已经批准的ICI适应症:恶性黑色素瘤、肺麟癌、肺腺癌、小细胞肺癌、肾细胞癌、经典霍奇金淋巴瘤、头颈部恶性肿瘤、胃癌、恶性胸膜间皮瘤、尿路上皮癌、默克尔细胞癌、结直肠癌、食道癌、膀胱癌(其他联用)、胰腺癌(其他联用)、三阴乳腺癌。
Q06.新免疫检查点的研究如何
Answer
除上述之外,目前还有一些正在开发的,以解除免疫抑制为目的的抗体药物。
例如,日本国立癌症中心正在开发CCR4抗体用于治疗实体肿瘤。CCR4是表达于免疫细胞上的受体,该抗体药物有望消除抑制性T细胞。这种机制与PD1抗体药物完全不同,癌细胞通过抑制性T细胞增殖,可通过减少抑制性细胞的做法增强攻击性T细胞的能力以达到抗癌目的。
实际上,抗CCR4抗体莫加单抗(Mogamulizumab)是世界上第一个获批的治疗成人T细胞型白血病-淋巴瘤的抗体药物。治疗实体肿瘤的Ⅰ期临床试验已于2013年开始,这项研究旨在利用该药物清除调节性T细胞,以解除免疫抑制作用。自2013年以来,已在日本的6家医疗机构进行了1期临床试验,评估已进展或复发的实体瘤的安全性和清除效果。
此外,德国正在开发的携带免疫因子TNF-β的PD-1抗体药物,代号M7824,有人说它时二代PD1。理论上免疫环境中TNF-β的增加可以增强抗PD-1抗体的疗效,我们拭目以待。
上文介绍过的LAG-3也是免疫刹车型免疫检查点分子,不再累述。
Q07.免疫检查点抑制剂有什么作用
Answer
ICI的作用和效果与传统的细胞毒性化疗药物以及靶向药物完全不同。这意味着对ICI有效的患者可以长期生存。
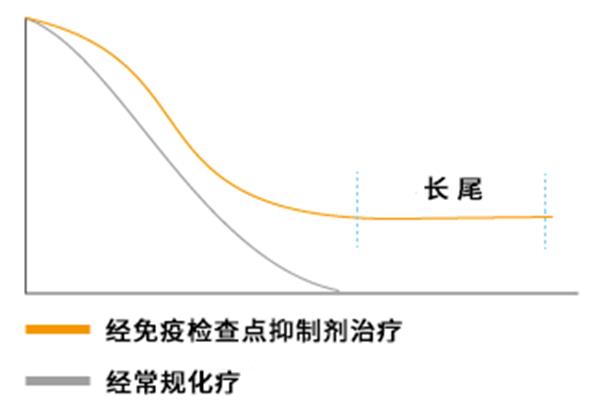
统计化疗药物的作用时,通常使用Kaplan-Meier曲线来分析患者的生存状况。曲线显示了随时间变化,患者生存情况,细胞毒性抗癌药物的生存虚线随时间推移呈下降趋势,有明确的终点。经ICI治疗后曲线下降到中间位置后,呈水平直线延申而不再下降(图5)。这种现象称为“tail plateau”(长尾),表明对ICI有反应的患者获得了长期生存。
例如,在接受抗CTLA-4抗体的晚期恶性黑色素瘤患者中,有20%生存期超过10年。黑色素瘤已扩散到全身,仅使用伊匹木单抗即可生存超过10年,几乎可以治愈,这与任何传统疗法的意义都不同。
ICI用药次数少也是一个特点。伊匹木单抗的治疗,按1kg用3mg药物,每隔3周滴注一次,总共滴注4周即完成治疗。晚期恶性黑色素瘤患者中的2成,仅凭4次滴注就可以获得10年以上的生存。滴注的抗体激活了患者自体的免疫,免疫反应开始运行后治疗效果可持续。
实际上,ICI起效后肿瘤退缩或消失,药物还要用多久,并没有统一的认识。要得出结论,还需要进一步的科学研究和探索。
图5 ICI治疗后的生存曲线
Q08.用免疫检查点抑制剂需要注意什么
Answer
很遗憾,ICI并不是对所有的患者都有效,约对2成的癌症患者有效。而且几乎所有的癌种有效率都相似。也就是说单药使用ICI,8成的患者无法获益。
我们推测是原因可能出在癌症患者的个体特异性上。例如,与PD-1结合分子有PD-L1和PD-L2,L1和L2作用不同。发挥主要免疫抑制作用的,有人PD-L1强,有人PD-L2强,或者有的人问题出在CTLA-4,以及Treg上。这些都需要精准化区别对待。
最近发现使用ICI的癌症患者中约有1成不到的人,出现了肿瘤急速恶化(超进展)的现象,称为HPD(Hyper Progressive Disease)。为什么会发生HPD,直到现在也不十分明确。需要格外小心超进展现象。HPD在所有癌种中都有发生,主要集中在使用抗PD-1抗体患者中,使用CTLA-4抗体的也有报道。
鉴于这些,在使用ICI治疗前考虑每个患者的癌症特征,并仔细分析哪种药物策略最合适,非常重要。因此,我们迫切需要找到能够预测治疗反应的生物标志物,目前还在研究中。
Q09.免疫检查点抑制剂的不良反应如何
Answer
ICI的不良反应事件比细胞毒性化疗药物的发生率小,即使发生不良反应,其多数反应的程度也比较轻微。药物机制不同,不良反应的症状表现也不一样,有必要特殊对待ICI的不良反应。
ICI的不良反应,因解除免疫抑制后发生免疫反应过度而出现。因此,多表现为自体免疫疾病的症状,他们称为“免疫相关有害事件”(irAEs:immune‐relatedadverseevent)。
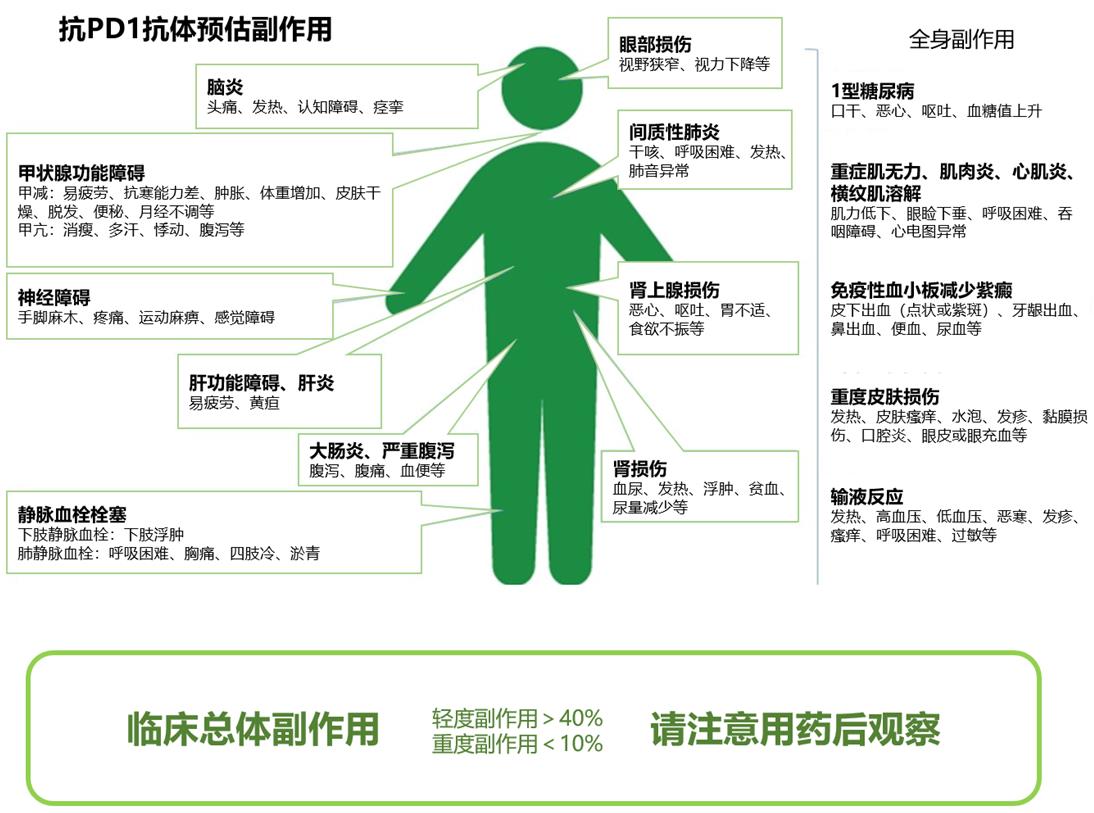
由ICI引起的与免疫相关有害事件,包括皮肤,消化系统,内分泌和神经系统等几乎所有脏器的炎症性免疫反应(图6)。其中重大的有害事件包括:
· 间质性肺炎
· 结肠炎,胃肠道穿孔
· 心肌炎,心力衰竭
· 暴发性1型糖尿病
· 过敏性休克
· 重症皮肤疾病
· 血小板减少症
· 脑炎/脑病
· 格林巴利综合征
· 急性继发性衰竭
· 肾炎/急性肾衰竭
图6.抗PD1抗体不良反应
常规的细胞毒性抗癌药物发生不良反应的,通过停药可以改善,但是ICI的不良反应即使停药,免疫相关的有害事件却常常持续。
为了防止重大的免疫相关不良反应,应尽早的发现端倪,尽早处理,以防治事态恶化。对于患者和家属,有必要在开始使用ICI前对不良反应有所了解。
在免疫检查点抑制剂的治疗中,必要时与每种疾病的专家合作也是必不可少的。因此,医院必须确保患者在开始免疫检查点抑制剂治疗之前接受必要的检查,内分泌药物治疗等,同时与各个领域的专家合作以预防副作用,把重点放在多学科医疗团队的建设上。从患者的角度来说,在选择最佳治疗方案之前,有必要考虑医疗团队的服务能力。
处理免疫相关的不良反应,单凭肿瘤专科的医生是有限的,需要内分泌、代谢等多学科医生组成团队共同为患者提供帮助。
Q10.免疫检查点抑制剂特有的治疗过程
Answer
使用ICI后,有时遇到一过性的肿瘤恶化后却发生缩小的逆转过程,这也是是免疫疗法的特征之一。
这种情况称为“假性进展”。当免疫细胞攻击癌细胞时,肿瘤会长大,看似肿瘤正在进展。这其实是发生免疫反应的证据,经过这个过程后肿瘤会持续缩小。那么,有超进展,也有假进展,需要临床医生仔细、耐心的观察与判断。
Q11.其他疗法是否与免疫检查点抑制剂联合使用
Answer
为了使患者更大受益,全世界有很多研究正在尝试ICI与与其他药物联合治疗。
例如,PD-1和CTLA-4的抗体药物具有明显不同的作用机制。通过临床试验能够证实联合使用疗效更佳的,会被政府的卫生部门批准联合使用。在海外,nivolumab(抗PD-1抗体)和ipilimumab(抗CTLA-4抗体)联合疗法于2018年5月用于黑色素瘤,同年8月用于肾细胞癌,2019年12月用于非小细胞肺癌,2020年初PD-L1抗体+CTLA-4抗体的联合方案又获批治疗肝癌。针对头颈部癌,胃癌,恶性胸膜间皮瘤,食道癌和尿路上皮癌的临床研究也正在进行中。
还有一些临床试验正在验证ICI与细胞毒性抗癌药物、分子靶向药物联合的疗效与安全性。
已经有报道显示白蛋白紫杉醇+抗PD-1抗体联用可改善临床疗效。白蛋白紫杉醇也对免疫发挥作用,与ICI联用可以增强免疫。
ICI与某些分子靶向药物联用也有积极作用。例如,靶向药物伊马替尼(商品名:格列卫)可以发挥免疫调节作用,含有增强免疫的有效成分。
Q12.免疫检查点抑制剂的基本用法是什么
Answer
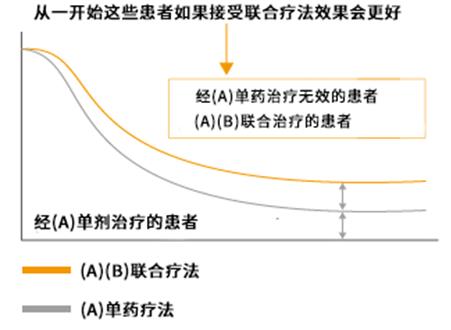
联合使用ICI时有些要点需要考虑。有20%的患者单药治疗效果已经很好。过去的数据告诉我们,化疗药物多剂联合的疗效大于单剂,可以延长生存期。但是,这个理论不适用于对ICI有反应的患者。给ICI单药存活可以超过10年的20%患者,再加上化疗药物以期待更好的疗效,属于画蛇添足。联合用药需要有临床证据佐证,把握基本的原则(图7)。以ICI为代表的免疫疗法,基本原则是“在需要时以需要的量使用需要的药物”。
图7 ICI何时需要联用
Q13.免疫检查点抑制剂的将来会怎样发展
Answer
展望ICI的未来,首先要明确预测ICI有效的标志物,和预测副反应的标志物。
同时,ICI的特性已经超出了化疗时代的“常识”,我们需要更深入了解免疫疗法的特性,改变陈旧观念,重新修正癌症治疗的策略。
例如,过去像大肠癌,肺癌,胃癌和乳腺癌等以器官为标的进行研究和治疗,而免疫疗法却不尽于此。按器官分别治疗癌症本身就是人类的主观决定。而在生物学意义上,识别癌细胞的性质更加重要。过去认为,治疗癌症的最佳方法是外科切除,所以聚焦于癌生在哪个部位。但是免疫疗法是不用切除也可以治疗的方法,我们必须理解,最重要的是把握癌细胞的的生物学特征。
现在,分子靶向药物领域已经开始突破按部位画区隔的枷锁,如ALK,EGFR和HER2的基因突变,在多癌种上体现,治疗需要超越癌种。就像曲妥珠单抗(产品名称:赫赛汀)可以用于HER2阳性的乳腺癌,也可用于HER2阳性胃癌治疗。
在癌症免疫疗法中,最早出现的跨癌种药物是派姆单抗(商品名:Keytruda),获准治疗局部晚期或转移性高频微卫星不稳定性高(MSI-High)癌症。
MSI-High是受损基因修复机制异常的生物标记物。我们机体中的基因由于各种内因外因而受损,目前认为基因受损的累积是发生癌症的原因,而基因受损后常被自体修复,因此我们很少发生癌症。但是,MSI-High的人们基因修复机制变得异常,导致基因进入受损累积而不能被修复的状态。
MSI-High测试结果呈阳性在多种癌症类型中存在,以胃癌、肠癌等消化道癌症为代表,修复机制异常是跨癌种的。派姆单抗和其他ICI对MSI-H的多种癌症有效。美国已于2017年5月批准其为世界上第一种交叉癌症治疗ICI。
PD-L1是一个预测PD-1抗体药物是否有效的标志物。PD-L1常发现于癌细胞及部分正常细胞表面,相对于T细胞的PD-1受体,PD-L1是与其对应的配体。
以肺癌为例,当50%以上的癌细胞上发现PD-L1时,表示强阳性;1%~49%为阳性;不足1%的判断为阴性。肺癌治疗中(不考虑个别情况),当发现PD-L1≥50%,且EGFR、ALK、ROS1、BRAF这4个驱动基因为阴性时,应该首选PD-1抗体单药治疗;当EGFR、ALK、ROS1、BRAF这4个驱动基因为阴性,癌细胞PD-L1表达在1~49%区间时,PD-1抗体药物或PD-L1抗体药物作为二线治疗使用;PD-L1小于1%的ICI预期疗效不大,ICI作为末线使用。
Q14.什么是免疫细胞疗法
Answer
基于免疫监视理论,从干扰素、白介素,到TILs、DC疫苗、CAR-T疗法、到目前最受关注的强免疫原性抗原Neoantigen(新生抗原)等,免疫细胞疗法是众多细胞、细胞疫苗类疗法的总称,基本方法是增强免疫识别,增强免疫细胞抗肿瘤活性。
免疫细胞疗法经历了约30年历程,虽然新的细胞方法更安全,也逐渐提高了疗效。但还有待进一步研究,目前只能将免疫细胞疗法作为辅助治疗方法,与手术、放疗、药物治疗以及ICI联合,以期待患者获益最大化。
Q15.免疫细胞疗法适合什么样的患者
Answer
免疫疗法与药物治疗的机制完全不同,化疗药物是细胞毒性合成剂,分子靶向药物以阻止增殖信号传导达到抗癌目的,而免疫疗法的机制均为激活自体免疫功能,利用自体免疫军队与敌军战斗。免疫细胞疗法是提高免疫监视,增加免疫军队的治疗方法,当肿瘤负荷重,敌军强大时,我军就会出现逃兵,甚至全军缴械(免疫抑制),免疫抗癌失效,ICI目的就是减少逃兵。单单增加免疫军队的细胞疗法抵抗癌症军队,虽然必要,但是有限。
细胞疗法与标准疗法并不冲突,标准疗法是经过多数验证的有效方法,细胞疗法是标准疗法的补充和辅助。就目前人类的科技水平,单凭一种治疗方法想解决癌症是不明智的。
根据目的不同,细胞疗法更适合以下几类癌症患者。
●初次手术、化疗后,放疗后的患者,目的是改善治疗副作用对机体免疫功能的消耗,尽早恢复正常免疫状态,对复发转移起预防作用。
●经多次治疗,目前处于稳定状态。如主要治疗使用相应有效的靶向药物,把细胞治疗作为辅助,能进一步增强疗效,走向治愈。
●肿瘤负荷相对可控,长期化疗,用细胞疗法维持免疫功能,期待免疫趋于平衡,达到更长期高质量生存的目的。
●免疫疗法的治疗费用都比较昂贵,需要有经济能力。
Q16.免疫细胞疗法有什么副作用
Answer
经基因编辑的免疫细胞疗法,可能出现强烈的副反应;通常的免疫细胞疗法,NK、αβT细胞疗法,以及DC疫苗等不会出现较强的副作用。少数患者在接收治疗后会发生一过性低烧、皮疹等轻微症状。
合并有间质性肺炎的患者,以及T细胞型淋巴瘤、HIV(艾滋病毒)携带者不能接收免疫细胞治疗。
Q17.免疫细胞疗法是否可以与免疫检查点抑制剂联合使用
Answer
免疫细胞疗法提高免疫监视能力,免疫检查点抑制剂解除免疫逃逸,是癌症治疗的大方向。目前科学发现,DC疫苗能够扩展免疫监视路径,T细胞自身需要一定的数量和活性才有可能攻击癌细胞,Treg细胞、PD-1通路和CTLA-4通路抑制了T细胞的活性,同时CTLA-4还增强Treg,并抑制DC的抗原递呈。
理论上免疫细胞疗法与ICI联合使用,可期待更大的治疗效果。但是高剂量的ICI与细胞疗法联合,可能出现更多、更严重的副反应,目前研究机构正在进行临床试验,以掌握安全剂量,并评估疗效。