靶向治疗是目前抗癌药物研究的热点,它所代表的是高端精准治疗的医疗理念。靶向治疗通过应用患者的基因突变信息,进而达到精准的防、治肿瘤的目的,是一种高效而又安全的治疗肿瘤的方法。相信通过前段时间邱医生的介绍,大家对靶向治疗都有了一定的认识,今天呢,邱医生再来帮各位小小的总结一下,提炼提炼靶向治疗重点内容。
现在国内外获批的靶向药物有很多,按照作用靶点可以归为以下的这几类:
1EGFR-TKIs
EGFR基因的常见突变位点发生在18、19、20和21号外显子上,其中19号外显子19缺失突变(19del)约占45%,21号外显子的L858R点突变占40%,这两种突变被称为常见突变(敏感突变)。其他的突变EGFR(G719X、S768I、L861Q)等被称为罕见突变。
目前免费的靶向药物临床研究
试验标题:
9291类似药YK-029A片对经既往EGFR-TKI治疗后由T790M基因突变获得性耐药和疾病进展的晚期非小细胞肺癌的I期临床研究
适应症:
对经既往EGFR-TKI治疗后由T790M基因突变获得性耐药和疾病进展的晚期非小细胞肺癌
试验目的:
主要目的是评估9291类似药YK-029A片的安全性和耐受性
试验信息
试验分类 安全性和有效性
试验分期 I期
设计类型 单臂试验
随机化 非随机化
盲法 开放
试验范围 国内试验
主要入选标准
1.18-65岁,EOCG 0-1
2.第一代或二代EGFR抑制剂(如吉非替尼、厄洛替尼等)半年以上,目前药物已经失效,T790M阳性的患者
3.有可测量病灶(病灶>1cm或淋巴结短径>1.5cm)
需提供资料:病理检查报告,基因检测,CT报告单(用药期间有缓解),出院记录,购药记录,查血单子等。
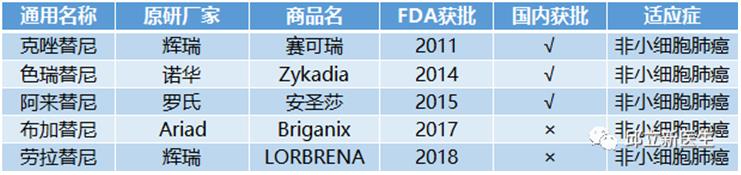
2ALK-TKIS
ALK(Anaplastic lymphoma kinase,间变淋巴瘤激酶)是一种受体酪氨酸激酶,属于胰岛素受体超家族,与白细胞酪氨酸激酶具有高度同源性。ALK基因位于人类染色体 2p23,编码 1620 个氨基酸的多肽,经过翻译后修饰,生成 200 ~ 220 kDa 的成熟ALK蛋白。ALK基因可激活多个细胞内信号通路,从而参与调节细胞生长、转化以及抗细胞凋亡的过程。
目前免的靶向药物临床研究
(可入组)
实验标题
X-396 用于克唑替尼耐药ALK阳性NSCLC患者的II期研究
适应症
ALK阳性NSCLC患者,既往接受克唑替尼持续治疗后疾病进展
实验目的
评价X-396胶囊在克唑替尼耐药的ALK阳性NSCLC患者中的有效性和安全性。
试验信息
试验分类: 安全性和有效性
试验分期: II期
设计类型: 单臂试验
随机化: 非随机化
盲法: 开放
试验范围: 国内试验
目标入组人数:国内试验144人
主要入选标准
1组织学或细胞学证实为局部晚期或转移性非小细胞肺癌患者(NSCLC)
2三级甲等医院书面报告证实为ALK阳性
3既往接受克唑替尼持续治疗后疾病进展(按照RECIST 1.1标准)
4性别:男女均可;年龄:≥18岁
5美国东部肿瘤协作组(ECOG)体力状态评分为0分-2分
6具有一定的器官系统功能(检测前14天内未进行输血或使用成分血),定义如下:中性粒细胞绝对计数≥1.5×109/L ;血小板≥100×109/L ;血红蛋白≥9 g/dL ;总胆红素≤1.5倍正常上限;若无肝转移,丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)≤2.5×ULN,肝转移时,二者≤5×ULN ;肌酐≤1.5×ULN。若肌酐>1.5×ULN,以Cockcroft-Gault公式法计算得肌酐清除率≥50 mL/min,或测得24小时尿肌酐清除率≥50 mL/min,则患者仍然可以入选
7不需要使用类固醇或抗惊厥药物治疗的无症状CNS转移
8患者必须有RECIST1.1标准可测量病灶
9除脱发外的药物相关毒性反应均应缓解至2级或以下
Ensartinib(X-396)
X-396是由美国Xcovery研发的第二代ALK抑制剂,浙江贝达药业获得Ensartinib项目在中国市场的所有权益。
2016年ASCO会议报道了Ensartinib II期临床部分数据,研究结果表明,未用克唑替尼的患者总有效率为88%,PFS最长已经超过32个月,进展的一名患者为Met扩增。克唑替尼耐药的患者总有效率为77%(10/13),PFS最长的为29个月。克唑替尼和色瑞替尼耐药的患者总有效率为29%。
药物服用方式:225mg,qd(II期临床剂量),空腹给药(饭前1小时或饭后2小时)。胃溶胶囊。
3ROS1重排
ROS1为原癌基因,属于酪氨酸激酶胰岛素受体的家族成员之一,在多种肿瘤细胞系中高度表达。
正常情况下,ROS1可激活与细胞分化、增殖、生长及存活相关的信号通路,包括PI3K-AKT-mTOR通路。可通过调节下游通路蛋白的磷酸化来激活下游信号通路,如PTPN11(PI3K-mTOR通路的激活因子)、AKT1、MAPK1和STAT3转录因子等。
而当ROS1基因与其他的基因发生融合,即通常意义上的“突变”,就会造成一个新的基因,这个基因能够驱动肿瘤的发生。
克唑替尼是目前唯一已经获批用于ROS1重排的靶向药物:2016年3月,FDA批准克唑替尼用于治疗ROS1突变的非小细胞肺癌。
2017年9月,NMPA批准克唑替尼用于治疗ROS1融合基因阳性晚期非小细胞肺癌。且在ROS1融合基因阳性Ⅳ期NSCLC一线治疗中,获得了2019版的CSCO指南Ⅰ级推荐。
从目前在研的药物可以看出用于ROS1重排的靶向药物与ALK基因突变的药物也有重叠之处。还有一些药物是获批了针对其他靶点的适应症,但在后期的针对ROS1突变患者的小样本临床研究中,表现出了非常好的疗效。因此,也正在积极开展相关临床试验。
目前免费的靶向药物临床研究
(可入组)
试验标题
X-396胶囊治疗ROS1阳性非小细胞肺癌的临床研究
适应症
组织学或细胞学证实为局部晚期或转移性ROS1阳性非小细胞肺癌患者
试验目的
评价X-396胶囊在ROS1阳性NSCLC患者的有效性和安全性,主要疗效指标为客观缓解率(ORR)。
试验信息
试验分类:安全性和有效性
试验分期:II期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
目标入组人数:国内试验59人
主要入选标准
1性别:男女均可;年龄:≥18岁。
2组织学或细胞学证实为局部晚期或转移性NSCLC(依据TNM分期系统2016第八版)。
3既往经三级甲等医院或其它合法医疗机构书面报告为ROS1阳性,且在入组之前提供诊断时/后获取的肿瘤组织学标本(包括细胞蜡块)或者活检组织标本送中心实验室进行ROS1检测(Amoy RT-PCR检验),确认为ROS1阳性;以探索性研究为目的纳入的克唑替尼复治患者必须在耐药后进行活检并将组织样本送中心实验室检测,确定为ROS1阳性。
4初治或化疗复治病人,且前次化疗结束距离X-396首次用药间隔至少3周。
5除脱发外的药物相关毒性反应均应缓解至1级或以下(依据CTCAE 4.03标准)。
6患者必须至少有一个未经过放射治疗的依照RECIST v1.1标准可测量的肿瘤病灶。
7具有一定的器官系统功能。
4MET基因突变
MET是一种原癌基因,也是多种癌症的驱动基因之一,一般不与EGFR、KRAS、ALK等肺癌其他突变共存。MET基因的突变类型有3种,分别是MET第14外显子跳跃突变(1%-3%)、MET原发扩增(1-5%)以及罕见的MET融合突变(<1%)。
目前有很多针对对MET基因突变的靶向药相关临床试验正在进行中。

目前免费的靶向药物临床研究
(可入组)
试验标题
沃利替尼对MET 外显子14突变的局部晚期或转移性肺癌的临床研究
适应症
MET 外显子14突变的局部晚期或转移性肺癌患者
药物介绍
沃利替尼是一种小分子新型靶向治疗药物,是c-Met受体酪氨酸激酶的高选择性抑制剂,在一系列临床前疾病模型中已证明其可有效地抑制肿瘤生长,尤其是对于c-Met基因扩增或c-Met 蛋白过度表达等c-Met 信号传导异常的肿瘤具有明显的抑制作用。
试验信息
试验分类:安全性和有效性
试验分期:II期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
主要入选标准
1.18岁及以上,ECOG 0-1
2.晚期肺肉瘤样癌或其他非小细胞肺,基因检测有MET外显子14突变且没有EGFR、ALK、ROS1突变,不能耐受含铂类药物治疗或含铂类药物治疗失败的患者
3.有可测量病灶(病灶>1cm或淋巴结短径>1.5cm)
需提供资料:病理检查报告,基因检测报告,CT报告单,出院记录,查血单子等
主要排除标准
研究治疗开始前 3周内进行过抗肿瘤治疗,包括化疗,激素治疗,生物治疗或免疫治疗,或者研究治疗开始前 2周内接受过小分子酪氨酸激酶抑制剂(例如EGFR-TKI)治疗;
研究治疗开始前 4周内接受广泛放射治疗(包括放射性核素治疗如锶-89)或研究治疗开始前 1周内接受过姑息性局部放疗或上述放疗不良反应未恢复;
研究治疗开始前 4周内接受过大手术或研究治疗开始前1周内接受过小手术(静脉置管术除外);
曾经接受过或正在接受任何针对 c-Met的治疗(例如:克唑替尼,Onartuzumab等);
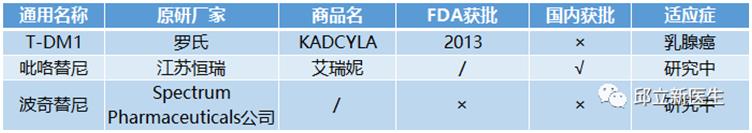
5HER-2基因突变
人表皮生长因子受体2(Human epidermal growth factor receptor 2, Her-2)属于ERBB受体酪氨酸激酶家族一员。该家族有4位成员,分别是ERBB1,ERBB2,ERBB3和ERBB4。其中ERBB1就是我们熟知的EGFR,关于EGFR我在前面的公众号详细描述过。ERBB2,就是Her-2,HER2与其他ERBB家族成员结合后所形成的异二聚体,在配体结合HER2后,HER2自身的酪氨酸激酶被激活,进而使其作用物磷酸化,并激活下游信号通路。
HER2基因突变是肺癌的致癌驱动因素,主要见于女性,不吸烟及肺腺癌患者。还可见于其他肿瘤,包括乳腺癌、卵巢癌、膀胱癌、唾液腺肿瘤、子宫内膜癌、胰腺癌等。HER2 20外显子的插入突变为主要突变类型,以p.A775_G776insYVMA多见,还包括p.G776>VC、p.P780_Y781insGSP、p.V777_G778insCG、p.M774delinsWLV、p.G776>LC和点突变p.L755S、p.G776C和p.V777L。
目前免费的靶向药物临床研究
(可入组)
试验标题
TAK-788治疗EGFR 20号外显子插入突变的转移性非小细胞肺癌的研究
适应症
携带EGFR 20号外显子插入突变的转移性非小细胞肺癌
试验信息
试验分类:安全性和有效性
试验分期:II期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国际多中心试验
主要入选标准
1、经组织学或细胞学证实为局部晚期(并且不是针对性治疗的候选人)或转移性疾病(IIIB或IV期)的NSCLC。
2、必须有足够的肿瘤组织进行分析(具体要求见《实验室手册》),首选在最近一次既往治疗期间进展后获得的肿瘤组织。
3、必须有根据RECIST v1.1确定的可测量的疾病。
4、年龄≥18岁的男性或女性患者。对于日本患者,年龄应≥20岁。
5、美国东部肿瘤协作组(ECOG)体能状态评分为0至1分。
6、预期最短寿命≥3个月
7、肾功能和肝功能良好,定义标准如下:a. 血清总胆红素≤1.5×正常值上限(ULN)(对于Gilbert综合征患者或者如果肝功能异常是基础恶性肿瘤所致,则可接受≤3.0×ULN);b. 丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)≤2.5×ULN(如果肝功能异常由基础恶性肿瘤所致,则可接受≤5×ULN);c. 肌酐清除率估计值≥30 mL/min(使用Cockcroft-Gault公式进行计算);d. 血清白蛋白≥2 g/dL;e. 血清脂肪酶/淀粉酶≤1.5×ULN。
8、骨髓功能良好,定义标准如下:a. 中性粒细胞绝对计数(ANC)≥1.5 × 109/L;b. 血小板计数≥75×109/L;c. 血红蛋白≥9.0 g/dL。
9、筛选时心电图(ECG)的QT间期正常,定义为QTcF≤450 ms(男性)或≤470 ms(女性)。
10、在TAK-788首次给药时,既往治疗导致的所有毒性均已消退至≤1级[根据美国国家癌症研究所不良事件通用术语标准(NCI CTCAE v5.0[18]),或已消退至基线水平。注:如果认为不可逆,允许存在与治疗相关的>1级脱发或与治疗相关的2级周围神经病变。
11、女性患者:在筛选访视前绝经至少1年,或手术绝育,或如果其具有生育能力,必须同意自签署知情同意书至研究药物末次给药后30天内同时使用1种高效的非激素避孕方法和另外1种有效的(屏障)避孕方法,或同意实施真正的禁欲,该方法应与受试者首选及一般生活方式一致。(周期性禁欲[例如,女性伴侣月经周期表记载法、安全期避孕法、症状体温法避孕、或排卵后方法]、体外射精、仅使用杀精剂以及哺乳期闭经避孕法是不可接受的避孕方法。女性和男性避孕套不可一起使用。)。男性患者,即使已接受过手术绝育(即,输精管切除术后状态):同意在整个研究期间至研究药物末次给药后30天内使用有效的屏障避孕法,或同意实施真正的禁欲,该方法应与受试者首选及一般生活方式一致。(周期性禁欲[例如,女性伴侣月经周期表记载法、安全期避孕法、症状体温法避孕、或排卵后方法]、体外射精、仅使用杀精剂以及哺乳期闭经避孕法是不可接受的避孕方法。女性和男性避孕套不可一起使用。)
12、已签署知情同意书并注明日期,表明受试者已知晓研究的所有相关方面。
13、愿意和能够遵守预定的访视和研究程序。
14、记录了通过本地测试证实的EGFR框内20号外显子插入(包括A763_Y764insFQEA、V769_D770insASV、D770_N771insNPG、D770_N771insSVD、H773_V774insNPH,或者任何其他框内20号外显子插入突变),并且有足够的肿瘤组织可用于中心实验室分析(参见《实验室手册》)。EGFR 20号外显子插入突变可以是单独突变或合并其他EGFR或HER2突变。注意:患者入组无需得到中心实验室确认。
15、脑转移患者符合以下标准可以纳入:接受过手术和/或放射治疗,并且在TAK-788首次给药前7天内无需皮质类固醇来控制症状即可达到稳定状态。
16、必须至少接受过局部晚期或转移性疾病的1线治疗并且不超过2种局部晚期或转移性疾病全身抗癌化疗方案的治疗。注:如果已给药至少1个周期,则将计入全身性抗癌化疗方案。用作维持治疗的新抗肿瘤化疗将被计入新的治疗方案。如果在入组前<12个月完成(新)辅助治疗,则新辅助或辅助全身性抗癌化疗将被计入既往治疗方案。允许入组接受过EGFR TKI既往治疗的患者,但在既往TKI治疗期间被研究者或治疗医师评价为客观缓解并随后进展的患者除外。
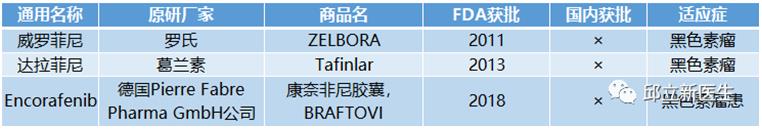
6BRAF抑制剂
BRAF基因是1988年由Ikawa等首先在人类尤文氏肉瘤中发现并克隆确认的,该基因位于染色体7q34,编码丝氨酸/苏氨酸蛋白激酶。RAF基因家族包含BRAF、ARAF和CRAF,BRAF与CRAF和ARAF具有较高的同源性,在恶性肿瘤形成、发展过程中发挥重要作用。
BRAF抑制剂又可以分为多靶点激酶抑制剂和BRAF V600E(单靶点)抑制剂两类。
多靶点激酶抑制剂:对包括BRAF在内的多种激酶均有抑制作用,这类抑制剂具有广谱的抗肿瘤及抗血管生成作用,适应症较广,例如索拉非尼(Sorafenib) 、瑞戈非尼(Regorafenib) 、培唑帕尼(Pazopanib)、ASN-003和CEP-32496等。
BRAF V600E(单靶点)抑制剂:对BRAF尤其是BRAF V600E有很高的抑制活性,这类抑制剂目前主要获批用于治疗黑色素瘤,如维罗菲尼(Vemurafenib,维莫非尼)、达拉菲尼(Dabrafenib)、PLX-8394和Encorafenib等。
目前招募未开始,后期邱医生会在公众号公布开始时间!
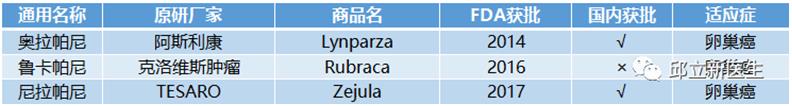
7BRCA基因突变
BRCA是人体的一种基因,包括BRCA1和BRCA2。BRCA1及BRCA2基因发现于上个世纪90年代,分别位于第17号和第13号染色体,均为抑癌基因,其蛋白产物参与DNA修复等过程。已发现的BRCA1/2 基因变异有数千种,其中一些是明确的致病性突变。BRCA1/2致病性突变在人群中的发生率大约0.1%-0.3%,其在德系犹太人这一高风险的种族中发生率可达2.1%。它们的突变与乳腺癌和卵巢癌有着密切的关系。多项临床研究显示,携带BRCA1/2基因突变的女性不仅乳腺癌、卵巢癌发病风险增加,其他如输卵管癌、胰腺癌等发病风险也增加,男性罹患乳腺癌、前列腺癌风险增加。
目前免费的靶向药物临床研究
(可入组)
试验标题
IMP4297治疗晚期卵巢癌、输卵管癌或原发性腹膜癌
适应症
携带种系和/或体系BRCA1/2突变,既往接受过至少2线标准系统治疗的由组织学或细胞学确诊的晚期非粘液性卵巢上皮癌,输卵管癌或者原发性腹膜癌
试验目的
主要目的:受试者的客观缓解率。次要目的:客观缓解率、疾病控制率、临床获益率、无进展生存期、总体生存期、缓解持续时间;探索性目的:探索性描述IMP4297的PK特征。评估药物暴露情况与疗效和AE之间的关系,评估给药后的生物标志物变化及其与药物暴露和疗效终点的相关性,探索同源重组修复缺失、杂合性丢失与疗效的关系。
试验信息
试验分类: 其他
试验分期: II期
设计类型: 单臂试验
随机化: 非随机化
盲法: 开放
试验范围: 国内试验
目标入组人数:国内试验100人
主要入选标准
1 所有受试者在开始研究相关操作前均需签署ICF;
2 ≥18岁由组织学或细胞学确诊的晚期非粘液性卵巢上皮癌,输卵管癌或者原发性腹膜癌的女性受试者;
3 由中心实验室确诊为胚系和/或体系BRCA1/2突变;
4 既往接受过不少于2线含铂化疗出现疾病复发或进展;
5 最近一次含铂方案治疗结束后≤6个自然月未出现疾病复发或进展(基于临床,CA125或者影像学判断);
6 根据RECIST v1.1标准,经独立的中心影像确认至少有一处可测量的病灶;
7 美国东部肿瘤协作组织体力状态(Eastern Cooperative Oncology Group Performance Status,ECOG PS)评分0-1分;
8MSI(微卫星不稳定)
微卫星不稳定( MSI) 又称复制错误,是指由于基因复制错误引起基因组中重复序列次数的增加或丢失,导致微卫星片段长度发生了缩短或延长。2 个或 2 个 以上位点的不稳定定义为微卫星高度不稳定( MSI-H) ;1 个位点不稳定为微卫星低不稳定( MSI-L) ; 0个位点不稳定为微卫星稳定(MSS)。最初的研究认为 MSI 是遗传性非息肉病性结直肠癌 ( HNPCC) 特征性的分子变化,与人类错配修复基因 ( MMR) 的种系突变有关。MSI-L和MSS等同于pMMR的概念,MSI-H等同于dMMR的概念。
最早期微卫星高度不稳定的检测主要针对结直肠癌,目的是帮助Lynch综合征的诊断。后来对于结肠癌术后的患者常规做微卫星不稳定检查,特别是II期的患者,通过微卫星不稳定检测决定是否需要化疗。近年来,随着免疫检测点抑制剂的使用,把MSI-H/MSI/MSS推向了风口浪尖。因为携带MSI-H的实体瘤(小肠癌、子宫内膜癌、结直肠癌、肺癌、胃癌等)对PD1/PD-L1效果比较好。
2018月,帕博利珠单抗(Pembrolizumab)获FDA批准用于治疗MSI-H/dMMR的实体瘤患者。这是FDA首次不依照癌种而是依照生物标志物核批的抗肿瘤疗法。同时也批准了Nivolumab(Opdivo®、欧狄沃)用于治疗MSI-H或者dMMR结直肠患者。
目前免费的临床研究
(可入组)
试验标题
HX008 注射剂治疗MSI-H 实体瘤的研究
适应症
MSI-H 实体瘤
试验信息
试验分类:安全性和有效性
试验分期:II期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内多中心试验
主要入选标准
1.18-70岁,EOCG 0-1
2.MSI-H 或 dMMR(微卫星不稳定)的实体瘤(如妇科肿瘤,肺癌,消化道肿瘤等)
3.含铂方案治疗失败或者不能耐受,没有用过PD-1/PD-L1药物治疗
4.有可测量病灶(病灶>1cm或淋巴结短径>1.5cm)
5.没有脑转移
需提供资料:病理检查报告,CT报告单,出院记录,基因检测报告,查血单子等
9KRAS基因突变
KRAS基因是科学家从人体内发现的第一个癌基因。早在1982年,科学家从人膀胱癌细胞系中克隆到了第一个癌基因,并很快确定这个癌基因是KRAS。后来进一步的研究也发现了KRAS突变致癌的原因,KRAS基因负责编码并制造一种称为K-Ras的蛋白,该蛋白属于MAPK/ERK信号通路途径(RAS-RAF-MEK-ERK通路)的一部分。因此KRAS基因就像人体内一个“开关”,它在肿瘤细胞生长以及血管生成等过程的信号传导通路中起着重要调控作用,正常的KRAS基因可抑制肿瘤细胞生长,而一旦KRAS基因发生突变,第12位氨基酸从甘氨酸变成了缬氨酸,这种变化会改变KRAS蛋白质的结构并使其一直处于激活状态,它就会持续刺激细胞生长,打乱生长规律,从而导致肿瘤的发生。
目前免费的靶向药物临床研究
试验题目
HL-085联合多西他赛治疗KRAS突变的晚期非小细胞肺癌
适应症
KRAS突变的晚期非小细胞肺癌
试验目的
评价HL-085联合多西他赛治疗KRAS突变的晚期NSCLC的安全性和耐受性、确定最大耐受剂量(MTD)/推荐的Ⅱ期临床试验剂量(RP2D)和剂量限制性毒性(DLT)。
试验设计
试验分类: 安全性和有效性
试验分期: I期
设计类型: 单臂试验
随机化: 非随机化
盲法: 开放
试验范围: 国内试验
目标入组人数:27-39人
入组条件
1 根据 AJCC 第8版肺癌TNM分期标准,经组织学或细胞学确诊的、无法手术切除或转移性的Ⅲb-Ⅳ期非小细胞肺癌(NSCLC);
2 经标准治疗失败、不能耐受标准治疗或拒绝标准治疗的晚期NSCLC;
3 基线时能够提供足够的组织学标本进行基因突变检测并确定为KRAS突变;
4 根据实体瘤疗效评价标准(RECIST v1.1版)有可测量的病灶;
5 在研究药物给药治疗前,既往化疗、免疫疗法或放疗必须已完成至少4周,并且在研究药物给药前,所有相关毒性反应(除脱发)均已得到恢复(恢复至≤1级或基线水平);
6 用药前至少14天内未接受任何大手 研究治疗首次术(基线肿瘤活检除外)或发生严重创伤;
7 ECOG评分为0-1分;
10PIK3CA基因突变
PIK3CA突变约80%发生在螺旋区(Helical)和激酶区(Kinase)这两个热点区域,最常见的三个突变是外显子20上的H1047R,外显子9上的E542K和E545K。目前有相当多的研究证实,PIK3CA突变在许多不同类型的实体肿瘤中均存在,其中,发现概率较高的主要有:肺癌、结直肠癌和乳腺癌。
目前免费的靶向药物临床研究
试验题目
Ipatasertib 联合紫杉醇治疗 PIK3CA/AKT1/PTEN-基因改变的局部晚期或转移性,三阴性乳腺癌或激素受体阳性、HER2 阴性乳腺癌三期临床研究
适应症
三阴性乳腺癌或激素受体阳性、HER2 阴性乳腺癌
试验目的
评价ipatasertib联合紫杉醇(ipatasertib+紫杉醇)相比安慰剂联合紫杉醇(安慰剂+紫杉醇)在PIK3CA/AKT1/PTEN-基因改变肿瘤患者中的安全性、疗效和药代动力学。
试验设计
试验分类: 安全性和有效性
试验分期: III期
设计类型: 平行分组
随机化: 随机化
盲法: 双盲
试验范围: 国际多中心试验
目标入组人数: 总体450人, 中国13人
入选标准(部分)
1 年龄≥18 岁的女性或男性
2 东部肿瘤协作组体能状态为0 或1
3 周期1 第1 天首次研究治疗前14 日内血液和器官功能充分,采用以下定义标准:中性粒细胞(ANC≥1500/μL);血红蛋白≥9 g/dL;血小板计数≥100,000/μL;血清白蛋白≥3 g/dL;总胆红素≤1.5倍正常值上限(ULN),以下情况除外:血清胆红素水平≤3 倍ULN 的已知吉尔伯特病患者可入选研究。AST 和ALT≤2.5 倍ULN,以下情况除外:记录证明肝或骨转移的患者的AST 和ALT 可≤5 倍ULN。ALP≤2 倍ULN,以下情况除外:已知累及肝脏的患者ALP≤5 倍ULN;已知累及骨骼的患者ALP≤7 倍ULN;PTT(或aPTT)和INR≤1.5 倍ULN(接受抗凝治疗的患者除外);接受肝素治疗的患者的PTT(或aPTT)应在1.5 和2.5 倍ULN(或开始肝素治疗之前的患者数值)之间。接受香豆素衍生物治疗的患者间隔1 至4 天的2 个连续测得INR应在2.0 和3.0 之间;血清肌酐<1.5 倍ULN 或肌酐清除率≥50 mL/min,基于Cockcroft-Gault 肾小球滤过率估算; 空腹总葡萄糖≤150 mg/dL 且HbA1C≤7.5%
11抗VEGF单克隆抗体
贝伐珠单抗(安维汀)是第一个针对VEGF靶点的人源化的单克隆抗体,具备高亲和力且特异性地结合 VEGF,达到抑制肿瘤血管增生的作用。 用于转移性结直肠癌的一线治疗、非鳞状非小细胞肺癌、复发性胶质瘤等多个适应症。安维汀如果是两周使用的剂量为5mg/kg,如果是三周使用的剂量为7.5mg/kg。按50kg的病人来说,一个月使用安维汀的剂量为500mg,目前市场上的安维汀是100mg 一支,每支单价 1935元。
12抗EGFR单克隆抗体
西妥昔单抗(cetuximab,又名IMC-C225,Erbitux)是目前临床上最为先进的抗EGFR人/鼠嵌合单克隆抗体,它选择性地与表皮生长因子受体(EGFR)结合,在临床前试验中显示对多种肿瘤细胞株具有抗瘤活性。已被证实它对头颈部癌,非小细胞肺癌和结肠癌等多种肿瘤有效。西妥昔单抗 使用之前必须做基因检测,如果存在RAS、BRAF野生型才可以使用爱必妥。初始计量为400mg/㎡,其后每周250mg/㎡。
13TP53突变
TP53基因,又称为p53基因,和前面介绍过的BRCA一样,都属于抑癌基因,它也是我们体内一个非常重要的抑癌基因。TP53基因是因为编码一种分子量为53kDa的蛋白质“P53蛋白”而得名,这个蛋白的重要作用之一就是通过下游信号通路来调控细胞的分裂和增殖。正常情况下,保证每个细胞各司其职,大家一起努力维护人体内的“生态平衡”,保证机体的正常运转。
也可以简单的将TP53基因理解成是癌症这辆“载满坏蛋的货车”的“刹车”。正常情况下,刹车正常工作,这辆“坏蛋”货车就到不了目的地,癌症就没法发生、发展;而当这辆车的刹车失灵的时候,货车停不下来,到达了目的地,癌症就会有机可乘。
TP53基因可根据其基因变异分为野生型和突变型,突变型的p53抑制肿瘤发生发展的功能上有所缺陷,携带突变型的人群会增加肿瘤患病风险。
目前招募未开始,后期邱医生会在公众号公布开始时间!
14NTRK突变
NTRK基因家族包含NTRK1、NTRK2和NTRK3,分别代表染色体上三个不同的基因位点。正常情况下他们各司其职,其中:NTRK1基因编码TRKA,与神经营养因子(NGF结合);NTRK2基因编码TRKB,与脑源性神经营养因子(BDNF)和神经营养因子4(NT-4)结合;NTRK3基因编码TRKC,与神经营养因子3(NT-3)结合。
和前面介绍过的其他基因一样,如果任何一个位点的基因和其他的基因发生了融合突变,那么就会导致下游信号通路的异常,进一步的后果就是会驱动肿瘤的发生,目前3个基因融合导致的3个TRK受体结构激活被认为是实体肿瘤(包括肺癌、唾液腺癌、甲状腺癌和肉瘤)的致癌因素。
目前免费的靶向药物试验
试验题目
晚期实体瘤或原发性中枢神经系统肿瘤儿童患者口服TRK抑制剂larotrectinib I/II期研究(研究药物在NTRK阳性儿童受试者的有效性和安全性)
适应症
NTRK融合基因阳性实体肿瘤
试验目的
本研究是验证Larotretinib在儿童肿瘤患者中的安全性。该肿瘤必须存在特定(NTRK)基因改变。研究药物限制肿瘤细胞中NTRK基因的活性而治疗肿瘤。研究的第一部分(I期)验证儿童受试者中,剂量的安全性,药物在体内的吸收和改变,对于肿瘤的作用。第二部分(II期)主要目的是药物治疗的作用及其时长。
试验设计
试验分类:安全性和有效性
试验分期:其它
设计类型:单臂试验
随机化:随机化
盲法:开放
试验范围:国际多中心试验
入选标准
1 I期:在C1D1,患者从出生至21岁间,有局部晚期或转移性实体瘤或原发性CNS肿瘤,且肿瘤复发、进展或对现有治疗无应答,没有标准的或可用的系统性治愈性疗法;或:刚出生及更大的婴儿,被诊断为恶性肿瘤且已有记录证实NTRK融合基因,肿瘤已进展或对现有疗法无应答,且无标准的或可用的治愈性疗法。或:研究者认为通过损伤外形手术或截肢才能实现完整手术切除的局部晚期IFS患者。
2 I期剂量递增队列已完成入组。
3 期剂量扩展:除上述入选标准外,有资格入组本队列的患者必须是有记录证实NTRK融合基因的恶性肿瘤患者,IFS、CMN或SBC患者除外。入组本队列的IFS、CMN或SBC患者需有通过FISH或RT-PCR检测出ETV6重排或通过NGS检测出NTRK融合的证据。
4 II期:-C1D1时刚出生及更大的患有局部晚期或转移性IFS的婴儿患者,局部晚期IFS患者需经研究者判断后认为通过损伤外形手术或截肢方可达到完整的手术切除。或:C1D1时刚出生至21岁的局部晚期或转移性实体瘤或原发性CNS肿瘤患者,肿瘤已复发、已进展或对现有疗法无应答,并且无标准的或可用的全系统性治愈性疗法,已证实NTRK融合基因(或为IFS、CMN或SBC时有通过FISH或RT-PCR证实ETV6重排或通过NGS证实NTRK融合基因)(通过CLIA或其他类似认证实验室常规进行的分子检测确定)。NTRK融合基因阳性良性肿瘤患者也有入组资格。或:(包括扩展阶段)肿瘤诊断为儿童患者的典型组织学类型和NTRK融合基因的21岁以上的潜在患者,在当地研究中心的研究者与申办者的医学监查员进行讨论后可考虑入组。
5 原发性CNS肿瘤或脑转移患者
6 Karnofsky(≥16岁)或Lansky(<16岁)体力状态评分至少为50
7 具有足够的血液学功能
8 肝肾功能正常
15NRG1基因融合
神经调节蛋白-1(NRG1)基因融合是一种新兴的,可能有效的致癌驱动基因。NRG1融合可通过MAPK和其他经典途径促进病理信号传导。 当存在NRG1融合体时,靶向ERBB2和ERBB3已成为体外有效的治疗策略。
目前招募未开始,后期邱医生会在公众号公布开始时间!
以上,是关于靶向治疗的小小总结,篇幅有限,所以很多东西都省略了,部分药物的靶点以及适应症等信息并不全面,在前面的表格中我只罗列了较为有代表性的一些。
因为,目前很多的靶向药覆盖的靶点不止一个,获批适应症也不止一个,国内外的获批也不一样。总的来说,很多国外原研的药物适应症获批这一块,还是走在中国前面的。不过,我们也正在逐步追赶国外的步伐,国内有很多临床试验正在做,包括外企原研的、国内原研的和国内仿制的都有。
大部分药物疗效都是确认的,这就是免费用药的好机会呢,对于国内的患者而言简直是打着灯笼都难找的好事。一旦等到药物在国内上市了,就错失了这样大好的机会,到时都是明码标价,只能花大价钱去买。
另外,不用我说,大家都知道,一般的靶向治疗药品才上市的时候,价格都比较贵,并且很多时候都是供不应求的,可能有钱也不一定能买到。
最后,邱医生还是要说,对于临床试验,大家不要有太大的心理负担,参加临床试验并不是小白鼠。有很多很多的患者是抢着想入组临床试验的。
早些时候免疫治疗比如“O药”纳武利尤单抗刚开始入组中国患者,想做上市前临床研究的时候,有很多患者听到消息都是主动来找我咨询,因为此前“O药”在国外的临床试验取得了非常好的疗效,但是去国外治疗花费太大,所以大家在听到这一消息的时候都很想在第一时间去尝试。最后患者由于自身一些原因没能成功入组,患者本人感觉到非常非常遗憾,认为错失了一个很好的治疗机会。后来,“O药”上市,患者家属第一时间要求使用,最后用下来发现疗效很不错。所以说,不要害怕尝试新事物,勇敢地迈出第一步,想必后面的每一步都会更顺利的。
什么样的患者合适免疫治疗?
来自国际及国内指南观点(ESMO/ASCO/NCCN)
1)肺癌 小细胞肺癌 晚期患者一线选择PD-L1抑制剂 阿特珠单抗+化疗。
非小细胞肺癌 K药(keytruda)用于一线治疗非小细胞肺癌的PD-1抑制剂。
2)乳腺癌 三阴性乳腺癌晚期患者一线选择PD-L1抑制剂 阿特珠单抗+化疗。
3) 胃癌 无论PD-L1表达是否为阳性,O药(Nivolumab)用于三线胃癌。PD-L1表达为阳性,K药(keytruda)用于三线胃癌。
4)肝癌 O药(Nivolumab)用于索拉菲尼耐药后的肝癌二线免疫治疗。
5)结直肠癌 Pembrolizumab(派姆单抗,Keytruda)或者nivolumab(纳武单抗,Opdivo)或者nivolumab与ipilimumab联合使用用于氟尿嘧啶、奥沙利铂和伊立替康治疗后出现进展的微卫星高度不稳定(MSI-H)或错配修复缺陷(dMMR)的转移性结直肠癌。
6) 肾癌 肾透明细胞癌的高危患者一线选用nivolumab与ipilimumab联合使用。
7)经典霍奇金淋巴瘤 国产的信迪利单抗和卡瑞利珠单抗用于复发或难治性经典型霍奇金淋巴瘤的三线治疗。进口的Pembrolizumab(派姆单抗,Keytruda)和nivolumab(纳武单抗,Opdivo)用于复发或难治性经典型霍奇金淋巴瘤的三线治疗。
8)黑色素瘤 Pembrolizumab(派姆单抗,Keytruda)用于辅助治疗及晚期一线治疗,这是首个用于辅助治疗的肿瘤。nivolumab(纳武单抗,Opdivo)用于辅助治疗淋巴结受累或转移性病变的全切除黑色素瘤患者辅助及晚期一线治疗。国产特瑞普利单抗适用于既往接受全身系统治疗失败的不可切除或转移性黑色素瘤的治疗。
(注:一线治疗、二线治疗、三线治疗都是指晚期治疗,一线治疗是指根据患者病情可以首先选择或者标准选择的药物、一线治疗耐药以后、再选择二线治疗,二线耐药后在选择三线治疗)。
对PD-1抗体、PD-L1抗体效果好的人群主要有如下的特点:
(1)PD-L1表达高,PD-L1表达>1%即可用,PD-L1表达>50%疗效更好;
(2)肿瘤基因突变负荷TMB高,TMB>20/Mb疗效好;
(3)肿瘤组织中有大量免疫细胞浸润,也就是所谓的TIL高;
(4)微卫星高度不稳定即MSI-H;
(5)患者肿瘤大小较小、年龄较轻、身体一般情况较好等。
免疫治疗有无副作用,该如何处理?
免疫治疗带来的一系列副作用有个统一名称,叫“免疫相关不良事件”(immune-relatedadverse events,缩写为irAE)。大约有2/3的患者会出现免疫治疗相关不良事件,大约有1/7的患者会发生至少一种≥3级的不良事件。
常见的不良反应包括:皮肤毒性(斑丘疹和瘙痒)、疲乏、免疫性肝炎、免疫性肺炎、免疫性肠炎、免疫性肾炎、甲状腺功能减退。分为四级,分别采用不同的治疗方式。
· 1级不良事件,对症处理,不推荐使用糖皮质激素,可以继续使用免疫治疗;
· 2级不良事件,局部应用糖皮质激素或全身应用糖皮质激素(0.5-1mg/kg/d),可以继续使用免疫治疗;
· 3级不良事件,静脉使用1-2mg/kg/d强的松,连续使用三天后,症状缓解,强的松剂量减半,如果症状没有缓解的患者,可考虑联合使用免疫抑制剂治疗如英夫利昔单抗、麦考酚酸酯以及静脉用免疫球蛋白等进行治疗,此时应暂停免疫治疗,后期是否继续使用免疫治疗,要谨慎;
· 4级不良事件静脉使用强的松1-2mg/kg/d联合使用免疫抑制剂治疗如英夫利昔单抗、麦考酚酸酯以及静脉用免疫球蛋白等进行治疗,若症状缓解,逐渐减量至1mg/kg/d维持,后逐步减量,6周左右减量至停药,后期永久停用免疫治疗。
说了这么多,相信大家对于靶向治疗、免疫治疗和临床试验都有了更进一步的认识。最后文末设置了一些超链接,都是之前邱医生发过的靶向治疗和免疫治疗的文章。对于靶向治疗、免疫治疗以及相关临床试验感兴趣的朋友可以点进去,查看更加详细的信息。
另外,也可以直接来咨询我,添加微信或者关注公众号,能帮到您是我最大的荣幸。
转自邱立新医生微信公众号
