今期,国家药品监督管理局同时批准靶向药奥希替尼(泰瑞沙)用于EGFR突变阳性晚期或转移性非小细胞肺癌(NSCLC)成人患者的一线治疗。
01奥西替尼
奥西替尼为什么会成为EGFR突变患者的一线用药?
对于肺腺癌EGFR突变的患者来说,三代靶向药奥西替尼应该不会陌生。因为很多患者都知道一代靶向药吉非替尼、厄洛替尼、埃克替尼耐药后,会重新取组织或者血液做基因检测,如果出现EGFR T790M突变会选择三代靶向药奥西替尼继续口服。对于,现在肺癌EGFR突变的患者,一线就选择奥西替尼,总生存期延吗?会不会被提前使用?如果耐药这么办?毕竟相对于一代靶向药(2000+元),奥西替尼价格太贵(15000元/月)。带着这样的疑问,邱医生将会逐一解答。
2017年ESMO公布了FLAURA研究结果:三代靶向药奥希替尼VS一代靶向药(吉非替尼或者厄洛替尼)一线治疗EGFR突变的肺癌,结果显示:奥西替尼对于吉非替尼或者厄洛替尼延长了八个月的无进展生存期(PFS)(18.9 vs 10.2个月)!随后,美国获批了奥西替尼作为EGFR突变肺癌的一线治疗。

肺癌化疗到靶向治疗的跨越,实现了生活质量的提高,从一代靶向药换成三代靶向药,我们需要的不仅是生活质量的提高,还需要生命的延长。仅有无进展生存期(PFS)的延长,没有总生存期(OS)的延长,是远远不够的。最新的FLAURA研究没有让我们失望,总生存期(OS)结果显示,奥希替尼一线VS吉非替尼或厄洛替尼T790M耐药后使用奥西替尼(预估中位OS为41.4 vs 30.6个月),具体数据已今年的ESMO为准。为什么会出现这样的结果?因为一代耐药后出现T790M突变的人数大概只有25%,也就是一代耐药后四分之一的人可以使用三代靶向药,其余患者需要使用化疗等其他治疗手段。
奥西替尼副作用小,在FLAURA研究中奥希替尼的安全性比1代靶向药好(3级及以上AE:奥希替尼34% vs 1代药45%,AE导致的永久停药率:奥希替尼13% vs 1代药18%)。
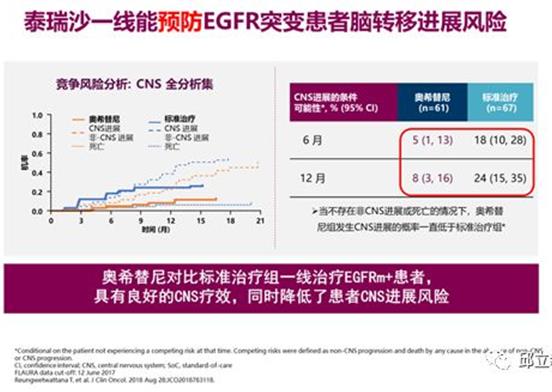
很多靶向药对脑转移束手无策,奥西替尼却可以!
在FLAURA试验中,对于CNS(中枢神经系统)转移的患者,奥希替尼组的中位PFS明显优于1代靶向药,为15.2m vs 9.6m。
所有556例患者出现脑转移进展(包括新发及已知脑转移)的发生率分别为奥希替尼组6%及1代TKI组15%,两组分别新出现3%(奥希替尼组)及7%(1代TKI组)的脑转移患者。
奥西替尼耐药,怎么办?
1) 基因检测后,当C797S突变是反式突变的话,可以泰瑞沙联合易瑞沙。如果C797S突变是顺式突变,可以穿插化疗、抗血管生成的靶向药物,以及适当空窗,等耐药基因丢失后,寄希望之前耐药的靶向药物可以重新复敏。
2) MET扩增,可以AZD9291联合克唑替尼/卡博替尼治疗。
3)基因检测HER2突变,可以选择吡咯替尼、波奇替尼。HER2扩增,可以使用TDM1或拉帕替尼。
4)当检测出PI3CA突变,可以使用9291联合mTOR抑制剂,如依维莫司等。
5)当病理检测发现患者已经转变为小细胞时,可以选择奥西替尼联合依托泊苷。
补充:四代靶向药也在研发当中,前期国外临床试验效果较好,相信不久,国内的临床试验即将展开,邱医生也会第一时间在公众号公布!
奥西替尼太贵,怎么办?
对于一般家庭来说,每个月15000元的费用确实很贵,我相信随着国家药品监督管理局批准靶向药奥希替尼(泰瑞沙)用于EGFR突变阳性晚期或转移性非小细胞肺癌(NSCLC)成人患者的一线治疗,中国的医保政策也会作相应的调整。目前,解决燃眉之急的办法就是,参加国产三代靶向药的临床试验。
目前免费的靶向药物临床研究
试验标题:
9291类似药YK-029A片对经既往EGFR-TKI治疗后由T790M基因突变获得性耐药和疾病进展的晚期非小细胞肺癌的I期临床研究
适应症:
对经既往EGFR-TKI治疗后由T790M基因突变获得性耐药和疾病进展的晚期非小细胞肺癌
试验目的:
主要目的是评估9291类似药YK-029A片的安全性和耐受性
试验信息
试验分类 安全性和有效性
试验分期 I期
设计类型 单臂试验
随机化 非随机化
盲法 开放
试验范围 国内试验
主要入选标准
1.18-65岁,EOCG 0-1
2.第一代或二代EGFR抑制剂(如吉非替尼、厄洛替尼等)半年以上,目前药物已经失效,T790M阳性的患者
3.有可测量病灶(病灶>1cm或淋巴结短径>1.5cm)
需提供资料:病理检查报告,基因检测,CT报告单(用药期间有缓解),出院记录,购药记录,查血单子等。
目前免费的靶向药物临床研究
试验标题:
马来酸艾维替尼胶囊治疗明确EGFR T790M状态的晚期NSCLC I期临床试验
适应症:
表皮生长因子受体(EGFR)突变或T790M耐药突变的局部晚期或转移性非小细胞肺癌
试验目的:
评估艾维替尼单药治疗在未经治疗的EGFR敏感突变阳性的NSCLC患者中的客观肿瘤缓解率(ORR)和无疾病进展生存期(PFS)
试验信息
试验分类 安全性和有效性
试验分期 I期
设计类型 单臂试验
随机化 非随机化
盲法 开放
试验范围 国内试验
主要入选标准
1.组织学或细胞学证实的IV期NSCLC或不能进行根治性手术或放射治疗的IIIB-IIIC期NSCLC(国际肺癌研究协会第八版肺癌分期);
2.根据RECIST1.1实体肿瘤疗效评价标准,患者至少有一处影像学(经CT或MRI检测)可测量病灶,在基线期可进行准确和可重复性的测量,CT或MRI扫描病灶长径≥10mm,(若病灶为转移淋巴结,则要求短径≥15 mm),并且病灶既往未经过放疗和未进行过活检(如果病人只有一个靶病灶并需要活检,可以允许对靶病灶进行活检,并且活检距筛查期肿瘤基线评估检查必须≥ 2周, 且活检后靶病灶仍符合RECIST靶病灶定义)。
3.有或无脑转移症状的患者均可入组。对于有症状脑转移患者,需研究者认为暂时不需要脑部局部治疗,并且2周内PS评分没有明显下降。如患者接受过脑部放疗,从放疗结束至本研究治疗开始需超过2周,并且放疗相关的毒性恢复至小于或等于1度(CTCAE分级)(脱发除外)。
4.肿瘤组织或细胞病理标本经本研究中心实验室检测证实存在EGFR敏感突变:19exon缺失突变、或L858R突变、或合并其他突变。
5.既往没有接受过针对晚期NSCLC的全身性化疗或任何其他系统性治疗。对于既往接受过术前新辅助化疗或术后辅助化疗或根治性放化疗的患者,如果疾病进展发生在末次治疗的一年之后,可以入组。既往接受过靶向治疗或免疫治疗的患者不能入组。
6.者在筛选时具备足够的重要脏器功能,包括:1. 近14天使用首次给药前≤14天内未使用造血刺激因子的情况下,绝对中性粒细胞计数(ANC)≥1.5x10^9/L;2. 首次给药前≤14天内未使用造血刺激因子或输血的情况下,血小板≥100×10^9/L;3. 首次给药前≤14天内未使用造血刺激因子或输血的情况下,血红蛋白>90g/L;4.天门冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)≤2.5XULN(ULN=正常值上限)。5. 总胆红素 ≤1.5XULN(ULN=正常值上限) 6. 凝血功能INR≤1.5 7. 血肌酐≤1.5×ULN (ULN=正常值上限) 并且肌酐清除率(采用Cockcroft and Gault公式计算)≥50 ml/min;
7.允许在研究入组前一周完成姑息性放疗,并且放疗相关的毒性恢复至小于或等于1度(CTCAE分级)。
8.既往没使用过任何抗肿瘤作用的中药,或曾使用过抗肿瘤作用的中药但次数不超过3次(1剂即为1次),且在本研究药物治疗前已停药2周及以上。
9.ECOG评分:0或1分,且最近2周内没有恶化迹象;且预期生存时间:>12周.
转自邱立新医生微信公众号
